فصل سوم
اختلالات اتوایمین پوستی بولوز
اختلالات اتوایمین پوستی بولوز
اپیدرمولیز بولوسا اکوایستا(EBA) برای اولین بار قبل از قرن بیستم شرح داده شد و به عنوان یک شکل بدست آمده از اپیدرمولیزبولوسا (EB) به دلیل ویژگی های بالینی همچنین یادآور کودکانی که با اشکال ژنتیکی دیستروفیک EB متولد شدند مطرح شد (EBA (1985Elliott) یک دستاورد بیماری تاولی تخت اپیدرمال می باشد و به عنوان یکی بیماری تاولی اولیه از پوست طبقه بندی می شود. در فرم کلاسیک ،آن را یک بیماری مکانوبولوس همراه با شکنندگی پوست و تاول ضربه القا شده که دارای کمترین التهاب و التیام را همراه با زخم و میلیا داشته – ویژگی های است که بسیار یادآور اشکال دیستروفیک ارثی از اپیدرمولیز بولوسا(DEB) می باشد. در DEB یک نقص ارثی در ژن کد کننده برای کلاژن نوع VII (مهارفیبریل) که منجر به کمبود فیبرهای لنگری می شود ، وجود دارد. فیبرهای لنگری ساختارهایی که لنگر اپیدرم و زمینه آن منطقه غشاء پایه و فرایند های غشایی (BMZ) بر روی درم می باشد.(۱۹۹۴ Uitto and Christiano) 1975 Briggaman and whaler در EBA همچنین کمبود فیبرهای لنگری وجود دارد ، اما دلیل این است که در بیماران EBA آنتی بادیها IgE بر علیه کلاژن نوع VII در فیبرهای لنگری را مورد هدف قرار می دهند . EBA نشان دهنده یک مکانیزم خود ایمنی ایجاد شده است که توسط آن فیبر های لنگری می تواند بخاطر یک نقص ژنی به خطر بیافتد. از آنجا که EBA به عنوان بیماری خود ایمنی ( پسوریازیس ، سندرم خستگی مزمن ، ام اس)برای کلاژن نوع VII تعریف شده است ، آشکار شده است که EBA نیز ممکن است همراه با تظاهرات بالینی وجود داشته که یادآور پمفیگوئید تاولی (BP) ، پمفیگوئید سیکاتریسی(CP) و پمفیگوئید برانستینگ پری می باشد.
در اوایل قرن ۱۹۷۰ Roengk و همکاران ۱۹۷۱ EBA را در سراسر جهان بررسی نمودند ، سه مورد جدید گزارش و اولین معیار تشخیصی برای EBA ارزیابی شد: تاول خود به خود و یا ضربه القا شده شبیه DEB ارثی شروع در بزرگسالان سابقه خانوادگی منفی برای EB و حذف تمام بیماری های تاولی دیگر . در سال Yaoita1980 و همکاران ۱۹۸۱Nieboer و همکاران ۱۹۸۰ دریافتند که EBA مانندBP نشان دهنده انباشت IgG در محل اتصال درم اپیدرمال می باشد(DEJ ) در EBA با این حال انباشته های IgG در داخل و زیر محفظه لایه دنزا از BMZ یافت می شود ، در حالی که در BP آنها بالاتر ، داخل شبه دسموزوم و لایه لوسیدا قرار می گیرند . محل زیر لایه دنزا از رسوب IgG در EBA قابل درک بوده زمانی که آن بعنوان پروتئین پوست که توسط آنتی بادی های IgG برای کلاژن نوع VII هدف قرار می گیرد در فیبرهای لنگری که بصورت عمودی بیرون می آید از لایه دنزا به داخل درم پاپیلاری بالا می رود تشخیص داده می شود (۱۹۸۸،۱۹۸۴ Woodly et al) واحد اولیه کلاژن نوع VII یک زنجیره آلفا ۲۹۰ کیلو دالتون است که EBA خود آنتی ژن می باشد.
علل و پاتوژنز
علل و اپیدمیولوژی
علت EBA به طور کامل مشخص نمی باشد . بدلیل اینکه خصوصیات بیماری آنتی بادیها IgG بر علیه کلاژن نوع VII عمل نموده ، تصور بر این است که EBA یک پاتوژنز خود ایمنی دارد (۱۹۸۸ ۱۹۸۴ Woodley et al ) مشابه eba بیماران مبتلا به لوپوس سیستمیک اریتماتوز تاولی (SLE) نیز اتو آنتی بادی بر علیه کلاژن نوع SLE VII را توسعه می دهند (۱۹۸۵ Gammon et al ) هر دو بیمار EBA و SLE تاولی اغلب آنتی ژن لکوسیتی مشترک انسان HLA سازگاری بافتی اصلی MHC پروتئین سطح کلاس II سلولی ، HLADR2 دارند (۱۹۸۸B GAMMON ) این فنوتیپ HLA با بیش ایمنی که دوباره نشان دهنده علل خود ایمنی برای EBA می باشد مرتبط است.
EBA یک بیماری نادر با وقوع ۱۷/۰۲۶/۰ در هر میلیون نفر در غرب اروپا می باشد(EBA 1995Zillikens et al 1995Bernard به نظر می رسد شیوع کمتری ازBP داشته اما ممکن است همانند CP بارداری پمفیگوئید IgA خطی درماتوز تاولی حداقل شیوع را داشته باشد. اگر چه هیچ تمایل نژادی یا جنیستی تعریف شده وجود ندارد (Gammon 1993 and Briggaman ) که اخیرا مطرح شده است تمایل بالایی در جمعیت کره ای ها دارد ۱۹۹۸ Lee سن شروع به طور گسترده از اوایل دوران کودکی تا اواخر زندگی بزرگسالان متفاوت می باشد اما در اغلب موارد بین دهه چهارم و پنجم زندگی شروع می شود (۱۹۹۱ Gammon 1988 Arepey et al .
کلاژن نوع VII از سه زنجیره آلفا یکسان تشکیل شده است که به یک ساختار مارپیچی سه گانه پیچ می خورد . هر زنجیره آلفا ۲۹۰ کیلو دالتون می باشد. با این حال ، نیمی از اندازه هر یک از زنجیره آلفا توسط دمین بزرگ ، کروی ، غیر کلاژنی در انتهای آمینو مولکول مصرف می شود . این دمین کروی ۱۴۵ کیلو دالتون و دمین ۱ غیر کلاژنی (NCI) نامیده می شود. در انتهای دیگر از زنجیره آلفا پایانه کربوکسیل یک دمین کروی غیر کلاژنی بسیار کوچکتر به نام NC2 وجود دارد که فقط ۳۴ کیلو دالتون می باشد. در بین این دو دمین کروی ، یک یک دمین میله ای شکل طویل ، حلزونی، کلاژنی که با تکرار توالی اسید آمینه Y X GLY مشخص می شود ، وجود دارد Burgeson 1986 Sakai et al ).
در فضای خارج سلولی ، مولکول های کلاژن نوع VII آنتی پارالل ، دیمر های دم Totail توسط اتصال دی سولفیدی از طریق کربوکسیل انتهایی کوچک nc2 همپوشان بین دو مولکول های کلاژن نوع vii تثبیت می شود . بخشی از دمین NC2 سپس بصورت پروتئولیتیکی حذف می شود .(۱۹۹۵ Bruckner Tuderman ert al ) دیمر های آنتی پارلل سپس بصورت جانبی برای تشکل فیبرهای لنگری با دمین های nc1 بزرگ کروی در هر دو انتهای ساختار جمع می شود.
بیماریزایی
اتو آنتی بادی ها بر علیه کلاژن نوع vii گمان می رود به مدت طولانی یک علت بالقوه EBA باشد. دمین NC1 شامل اپی توپ های آنتی ژنیک اصلی برای آنتی بادیهای EBA و SLE تاولی می باشد . (۱۹۹۶ Lapiere et al 1995 Jones et al ) 1993 Gammon et al آخرین مطالعات انتقال غیر فعال شواهد مستقیم تری ارائه داده اند که آنتی بادیهای EBA بیماری زا هستند آنتی بادیها مطرح شده در خرگوش مصون بر علیه دمین NC-1 از هر دو کلاژن نوع VII انسان و موش زمانی که در موش های با ایمنی قابل قبول تزریق شد باعث تشکیل تاول می شود. (۲۰۰۵ Sitaru et al2005 Woodley et al تغییرات پوستی توسعه یافته موش ها یادآور EBA با تاول های زیر اپیدرمی و دیستروفی ناخن می باشد. به طور مشابه تزریق آنتی بادی های EBA انسانی با گرایش خالص بر علیه یک ستون NC-1 به موش منجر به پیشرفت یک بیماری تاولی با بالینی ، بافت شناسی ، ایمنی ، و ویژگی های فراساختاری شبیه به EBA انسان می شود (۲۰۰۶ Woodley et al ) این آزمایشات انتقال غیر فعال بطور موفقیت آمیزی به شدت نشان می دهد که آنتی بادیهای EBA بیماری زا و قادر به ایجاد جدایی اپیدرمی درم در پوست می باشند.
مکانیسمی که آنتی بادیها باعث بیماری می شود به طور کامل روشن نشده است. دمین NC-1 شامل یک سری از دمین های درونی است که همسان با پروتئین های چسبناک مانند پروئین ماتریکس غضروف ، فیبرونکتین و دمین A فاکتور وون ویلبرند (VWF-A ) می باشد. (۱۹۹۴ Christion et al ) بنابراین دمین nc1 ممکن است اتصال کلاژن نوع VII به دیگر قطعات BMZ و ماتریکس تسهیل نماید .از آنجا که EBA اغلب با حداقل التهاب بالینی یا بافتی رخ می دهد ، این فرضیه ارائه شده است که اتو آنتی بادیهای هدف و سازش اپی توپ های عملکردی درروی دمین NC1 می باشند. پس از تداخل با فعل و انفعالات طبیعی بین NC1 و لیگاندهای ماتریکس خارج سلولیشان مانند لامینین ۵ و فیبروتکتین و چسبندگی اپیدرمی درم مختل می شود(۱۹۹۹ ۱۹۹VA Chen et al ) علاوه بر این احتمال وقفه ای در تعامل کلاژن فیبرونکتین نوع VII در دمین کلاژنی که ممکن است برای چسبندگی غشاء پایه و اپیدرم پوشاننده درم پاپیلاری دارای اهمیت باشد وجود دارد (۱۹۹۴ Lapier et al ) مشاهدات اخیر که برخی آنتی بادیها EBA از کودکان مبتلا به دیگر دمین های هدف EBA در زنجیره آلفا علاوه بر NC1 نشان می دهد که دمین کلاژنی حلزونی و شاید دمین NC2 نیز ممکن است نقش مهمی در حفظ کاملا عملکردی کلاژن نوع VII و فیبرهای لنگری بازی کند(Tanaka et al 1997) به عنوان مثال آنتی بادیهای برخی از بیماران EBA اپی توپ های آنتی ژنیک در هر دو دمین NC1 وnc2 تشخیص می دهد. و دمین بعدی به نظر می رسد در شکل گیری دیمر آنتی پارالل و مهار مونتاژ فیبرهای لنگری دارای اهمیت باشد(۲۰۰۰ Chen et al ) این مکانیسم ها فرضیه های جذابی برای توح شکنندگی پوست و تاول های تروما –القایی در بیماران مبتلا به eba کلاسیک که فاقد التهاب معنی داری بوده می باشد اما به طور قابل توجه چسبندگی اپیدرمی درم معیوب دارند.
در حال حاضر برای ما قابل درک است که EBA همیشه حاضر به عنوان یک بیماری ضربه تاولی غیر التهابی از DEB نمی باشد. اگر چه کمتر شایع می باشد، EBA ممکن است به عنوان یک بیماری التهابی ، گسترده ، وزیکولوبولوس که از نظر بالینی شبیهBP است مشخص شود. بنابراین ، احتمالا اینکه تشخیص اتوآنتی بادی از یک یا چند دمین از کلاژن نوع VII ممکن است یک آبشار التهابی را ایجاد کند که می تواند در نتیجه تخریب پروتئولیتیک اجزای ماتریکس در DEJ باشد که برای چسبندگی اپیدرم درم ضروری می باشند . اتوآنتی بادیهای EBA ممکن است تاول هایی با ایجاد التهاب موضعی با یا بدون تقویت تثبیت اجزا تولید کند. پاسخ التهابی ایجاد شده سپس باعث آسیب بافتی در DEJ شده ، که در نتیجه تشکل تاول می شود (۱۹۸۴ Gammon ) این مکانیزم ممکن است در بیماران EBA و SLE تاولی با التهاب حاد در BMZ توضیح داده شود. بخصوص هنگامی که نوتروفیل ها در پاسخ التهابی غالب باشند چراکه نوع التهاب مشخص کننده اشکال تجربی کمپلکس ایمنی و التهاب با واسطه اجزاء می باشد.
تظاهرات بالینی
تنوع زیادی در تظاهرات بالینی EBA وجود دارد. مخرج مشترک برای بیماران مبتلا به EBA خود ایمنی به کلاژن نوع VII (فیبرهای لنگری ) و کاهش فیبرهای لنگری می باشد.(۱۹۸۸Woodley et al 1988Woodley ) اگرچه طیف بالینی EBA هنوز تعریف نشده به نظر می رسد که حداقل پنج تظاهر بالینی EBA وجود دارد.
۱ تظاهرات کلاسیک که در ابتدادر EBA شرح داده شد و شباهت های نزدیک ویژگی های مشاهده شده در بیماران با اشکال ارثی DEB
۲ تظاهرات BP مانند
۳ تظاهرات CP مانند
۴ تظاهرات پمفیگوئید مانند پری Brunsting
۵ بیماری درماتوز تاولی IgA خطی (Labd ) مانند تشخیص دوران کودکی آن می تواند یادآور بیماری مزمن بولوز از دوران کودکی باشد.
EBA کلاسیک
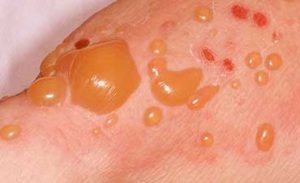
این شکل EBA نشان دهنده یک بیماری غیر التهابی تاول ضربه ای با توزیع اعضا می باشد. تاول ها و خوردگی ها با زخم و تشکیل میلیا التیام می یابد. این ارائه در فرم خفیف آن یادآور و تاردا پوستی پورفیری ، و در آن شدیدتر است اشکال یادآور ارثی DEB مغلوب است (Yaoitaو همکاران ۱۹۸۱) با وجود شباهت بین EBA و پور فیری تاردا پوستی ، بیماران مبتلا به EBA با هیرسوتیسم photodistribytion اسکلرودرمی مانند تغییرات و سطح بالا از پورفیرین ادرار ارائه نمی (۱۹۸۸Woodley Woodley و همکاران ۱۹۹۸ EBA کلاسیک یک بیماری مکانوبولوز بوده که توسط شکنندگی پوست روی سطح مستعد تروما مشخص می شود. تاول ها ، خوردگی ها و زخم ها بر پشت دست ، پنجه آرنج زانو منطقه ساکرال و پا رخ می دهد . غالبا درگیری قابل توجهی از مخاط دهان با خوردگی و تاول های فرانک وجود دارد. بر روی پوست بدون کرک ، وزیکول ها و تاول فشردگی در پوست غیر ملتهب و یا زخمی شده به نظر می رسد . آنها می توانند هموراژیک بوده و می تواند منجر به خوردگی ، پوسته ها وفلس ، زخم ، زخم آلوپسی ، کیست میلیا و دیستروفی ناخن می شود. ضایعات با زخم و اغلب با تشکیل کیست های میلیا مروارید مانند در مناطق زخم شده التیام می یابد. در موارد شدید ، ممکن است فیبروز دست و انگشتان دست و تنگی مری بوجود آید(۱۹۹۱ Stewart et al 1998 Harman et al ) بافت شناسی جدایی پوستی اپیدرمی در bmz و حداقل التهاب را نشان داد.
تظاهرات BP – مانند
این بیماری با ویژگی های مشخص از بیماری خود ایمنی ( پسوریازیس ، سندرم خستگی مزمن ، ام اس)تاولی BP یا ترکیبی از ویژگی های مشخص از هر دو BP و ایجاد EBA کلاسیک نشان داده می شوند (Gammon et al ) 1984 1982 این شکل از تظاهرات EBA به عنوان یک عود وزیکوبولوز التهابی گسترده شامل تنه ، اندام و لایه پوستی که معمولا با خارش همراه می باشد. فشردگی تاول بر روی پوست ملتهب و / یا زخمی واقع شده است . بر عکس EBA کلاسیک ، شکنندگی پوست بر جسته و زخمی نبوده و شکل گیری میلیا ممکن است حداقل و یا وجود نداشته باشد . انتشار ضایعات به محل های تروما – مستعد محدود نی شود . بافت شناسی ارتشاح چند شکلی سلول های تک هسته ای و گرانولوسیت ها متوسط تا فشرده را نشان می دهد.
نوتروفیل ها اغلب گرانولوسیت غالب بوده ، اما گاهی اوقات ائوزینوفیل ها دیده می شوند.
تظاهرات CP- مانند
ویژگی های بالینی در این بیماران بطور نزدیکی مشابه کسانی که است که مشخصه CP را دارند. این شکل از EBA به عنوان یک بیماری تاولی با غالبیت درگیری مخاطی مشخص می شود.
بیمار ممکن است با خوردگی ها و زخم های دهان ، مری فوقانی ، ملتحمه ، مقعد و واژن(۱۹۹۸Harman et al 1991 Stewart et al 1979 Dahl با و یا بدون ضایعات مشابه بر روی پوست بدون کرک مشخص شود. به تازگی ، درگیری نای تظاهرات CP-مانند از EBA گزارش شده است (۱۹۹۹ Wieme at al ) همچنین یک گزارشی از درگیری مخاطی عمدتا بدون زخم وجود دارد (۱۹۹۸ Tokuda ) بر خلاف EBA کلاسیک بیماران مبتلا به تظاهرات CP مانند اغلب شکنندگی قابل توجه پوست شواهدی از ضایعات تروما القا شده و یا علاقه شدید برای تاول در سطوح پوست اکستانسور را نشان نمی دهد. بافت شناسی تاول های زیرپوستی و معمولا یک ارتشاح التهابی ترکیب شده در درم بالایی و در BMZ و زخم میکروسکوپی را نشان می دهد.
پمفیگوئید پری – Brunsting یک زخم زیر پوستی وزیکولوبولوز مکرر مزمن محدود به سر و گردن می باشد. بر عکس cp آن حداقل یا بدون دخالت مخاطی می باشد(Kurzhals et al 1998 Yancey 1991 ( آنتی بادیها IgG در BMZ انباشته شده اما اتوآنتی ژنیک هدف برای این آنتی بادیهای تعریف نشده است. به تازگی ، چندین بیمار از ویژگی های بالینی ،بافت شناسی و ایمیونولوژیکی از پمفیگوئید پری Brunsting گزارش شده است اما اتوآنتی بادیهای IgG شان بر علیه کلاژن نوع VII (فیبریل لنگری ) مورد هدف قرار می گیرند. (Kurzhals 1998 WooDLEY et al 1998 Choi et al 1993 joly et al 1991 et al بنابراین ما معتقدیم که پمفیگوئید پری Brumsting در واقع ممکن است یک تظاهر بالینی از EBA می باشد.
تظاهراتLABD-مانند
این شکل ازEBA توسط یک تاول زیر پوستی مزمن ، ارتشاح نوتروفیلی و انباشتگی IgA خطی در BMZ زمانی که توسط میکروسکوپ ایمونوفلورسانس مستقیم مشاهده شده است آشکار می گردد. ممکن است مشابه بیماری مزمن بولوز دوران کودکی و از ویژگی های وزیکول فشرده در نمونه حلقوی و درگیری غشاهای مخاطی مرتب میشود(۱۹۹۷ Callot Mellot et al 1997Park et al ) آنتی بادیها معمولا IgA و IgG و یا هر دو می باشند.
طبقه بندی تشخیصی این بیماران با آنتی بادی های IgA بر علیه کلاژن نوع VII رسوب کرده در مد خطی در طول BMZ مشخص نمی باشد. برخی از پزشکان به این بیماران همچنین صرفا LABD توجه داشته (۱۹۹۶Hashimoto et al ) در حالی که دیگران این بیماران به عنوان یک زیر مجموعه از EBA توجه دارند (۱۹۹۹Bauer et al 1989 Rusenko et al ) جالب است توجه داشته باشید که در مطالعه اخیر (۲۰۰۰Lee ) سرم ۲۰ بیمار EBA برای سرم ضد IgA آنتی بادی کلاژن نوع VII توسط ایمینوبلاگ مورد بررسی قرار گرفت محققان تیترهای کم از ضد IgA آنتی بادی کلاژن نوع VII در ۸۰ درصد از بیماران علاوه بر IgG شناسایی شده اند.
EBA یک بیمار نادر دوران کودکی با نشانه های متغیر می باشد. در مطالعه اخیر از ۱۴ کودک به مبتلا به EBA پنج تن از بیماران همچنین یک بیماری شبیه LABD و پنج بیمار مبتلا با فرم شبیه BP از EBA را نشان دادند . چهار فرزند باقی مانده با فرم ضربه تاولی کلاسیک از EBA را نشان دادند(۱۹۹۷Callot Mellot et al ) یازده تا از ۱۴ درگیری مخاط داشته و همگی رسوب IgG را در BMZ با ایمونوفلورسانس مستقیم علاوه بر دیگر واکنشگرهای ایمنی داشتند. ایمونوفلورسانس غیر مستقیم در ۱۰ تا از ۱۴ نمونه سرم بیمار مثبت بود ، آنتی بادی سرم غالب از کلاس IgG بود . اگر چه درگیری مخاطی مکرر و شدید در EBA دوران کودکی می باشد، پیش آگهی کلی و درمان مناسب تری در EBA بزرگسالان وجود دارد (Callot 1998 Edwards1997Mellot et al )
تظاهرات بالینی بیمار EBA ممکن است در طول دوره بیماری تغییر یافته و یا می تواند دو علامت مختلف همزمان را نشان دهد . حدود ۲۵ درصد از بیماران مبتلا به EBA ممکن است با ظاهر بالینی شبیه BP ظاهر شوند(مشاهده منتشر نشده) با گذشت زمان ، این بیماری از برخی بیماران در نهایت به شکل غیر التهابی تر کلاسیک EBA تبدیل میشود. اشکال هر دو کلاسیک و BP مانند(۱۹۹۱Stewart et al ) و اشکال cp مانند و bp مانند از بیماری ممکن است در همان بیمار همزیستی داشته باشند(۱۹۹۹Wieme et al ) فنوتیپ بالینی EBA یادآور CP خالص است که احتمالا نادرتر و در کمتر از ۱۰% از تمام موارد EBA رخ می دهد.
ارتباط EBA و SLE تاولی
گزارش هایی از بیمارانی با داشتن هر دو EBA و SLE تاولی(۱۹۹۳ Gammon and Briggman) وجود داشته است . در مقابل تظاهرات کلاسیک EBA ، بیماران SLE تاولی توسط تعریف باید مطابق با معیارهای انجمن روماتیسم آمریکا برای SLE باشد. بیماران به زنان جوان با وزیکول تاولی غیر تهاجمی گسترده با غالبیت مناطق در معرض نور آفتاب تمایل دارد. EBA اغلب بیماران در چهارم تا دهه پنجم نشان داده شده در حالی که SLE تاولی معمولا زودتر در دهه دوم و سوم مشخص می شود EBA اغلب سال ها وجود داشته در حالی که SLE تاولی بهبود یافته و ممکن است در کمتر از یک سال حل شود EBA به اندازه SLE تاولی به درمان با داپسون یا پردنیزون پاسخ نمی دهد . از نظر وجود بافت شناسی هنچنین می تواند متفاوت باشد. SLE تاولی ممکن است میکرو آبسه های مویرگی نوتروفیلی و واسکولیت را نشان داده ، که به ندرت در EBA دیده می شود.(۱۹۹۳ Gammon and Briggaman ) موسین در پوست مشبک در EBA بر خلاف تاولی SLE افزایش نمی یابد(۱۹۹۷Ackerman et al )
ارتباط EBA و دیگر بیماری های سیستمیک
در بررسی Roenigk از مطالب EBA جهان (Roenick ) آن اشاره شد که بسیاری از گزارش های موردی از EBA مرتبط با بیماری های سیستمیک مانند SLE ، دیابت ، بیماری التهابی روده ، آمیلوئیدوز ، تیروئیدیت خود ایمنی ، سندرم اختلالات اندوکرین چندگانه ، ارتریت روماتوئید ، فیروز ریوی ، سرطان خون لنفوسیتی مزمن ، thymoma ، دیابت و دیگر بیماری ها وجود داشته است (۱۹۹۸Woodley et al ) با این حال EBA یک بیماری نسبتا نادر بوده ، و بسیاری از این گزارش ها موردی می باشد . به نظر می رسد که این بیماری اغلب در ارتباط با EBA بیماری التهابی روده ، با تخمین ۲۵% از ۵۰ بیمار EBA توسط چان و وودی (۱۹۹۶) بررسی شده می باشد. همچنین نشان داده شده است که بیماران مبتلا به التهاب روده به خصوص بیماری کرون ، یک شیوع بالایی از آنتی بادی های گردشی بر علیه کلاژن نوع VII دارند (۱۹۹۷ Chen et al ) علاوه بر این کلاژن نوع VII اخیرا نشان داده شده در اپیتلیوم روده حضور داشته باشد (۱۹۹۶ Lohi et al ) از آنجا که کلاژن نوع VII هدف آنتی ژنیک برای اتوآنتی بادیها در بیماران مبتلا به EBA می باشد ما گمان می کنیم که خود ایمنی که برای کلاژن نوع VII در هر دو روده و پوست وجود دارد. ممکن است بیان کننده این باشد که چرا این بیماران اغلب بیماری التهابی روده دارند. حضور آنتی بادی کلاژن نوع VII در بیماران مبتلا به بیماری کرون ممکن است یک پدیده گسترش اپیتوپ بوده که به موجب آن التهاب اصلی توسط بیماری کرون برانگیخته شده می تواند اپیتلیال روده BMZ را نگران کند به طوری که اجزای BMZ می تواند تغییر یابد ، در نتیجه یک پیشرفتی در بیماری های خود ایمنی برای کلاژن نوع VII ایجاد می شود (۱۹۹۸Chan et al ) .
پاتولوژی
بافت شناسی ضایعات پوست در ابتدا ادم پاپیلاری و تغییر وزیکولی در طول DEJ و در مرحله بعد ، تاول زیر پوستی را نشان می دهد. درجات مختلفی از ارتشاح التهابی پوستی در تطابق با تظاهرات بالینی دیده می شود . تظاهرات کلاسیک ارتشاح التهابی کمی در پوست همچنین تظاهرات مخالف با BP مانند را نشان می دهد (Lever and Schaumburg Lever 1990( ارتشاح می تواند در اطراف عروق ، اطراف و در درون فولیکول یافت می شود. در انواع التهاب ، ارتشاح پوستی ممکن است سرشار از نوتروفیل ها باشد. ارتشاح ممکن با تعداد متغیری از ائوزینوفیل ها و سلولهای تک هسته ای مخلوط شوند. فیبروز ممکن است در ضایعات بزرگتر دیده شود (۱۹۹۷Ackerman et al ) . از آنجا که از تظاهرات بالینی و بافت شناسی متغیر می باشد، تشخیص EBA توسط پارامترهای بالینی و بافت شناسی به تنهایی دشوار می باشد.
مطالعات فراساختاری از پوست EBA کمبود فیبرهای لنگری و آمورف ، باند الکترون متراکم فقط در زیر لایه دنزا را نشان داده اند(Ray et al 1997Nutt Richer and Mc 1982 ) اگرچه آنتی بادیهای علیه فیبرهای لنگری در منطقه زیر لامینا دنزا از BMZ عمل می کنند . آن را باید ذکر نمود که این صفحه تقسیم تاول ممکن است در لایه لوسیدا یا منطقه زیر لامینا دنزا باشد که فیبر های لنگری در آن واقع شده اند(۱۹۸۹ Fine et al ) مطالعات نقشه ای ایمنی نشان داده اندکه تاول های EBA اغلب بالاتر از رسوبات ایمنی در لایه لوسیدا از هم جدا شده اند (FINE al ) دلیل این است که لایه لوسیدا پاشنه آشیل BMZ زیر پوستی بوده و حساسیت بیشتر از منطقه زیر لامینا دنزا برای عدم چسبندگی دارد(and Briggaman 1980Briggman et al 1975 Wheeler و همکاران (۱۹۸۰) نشان داده اند که انواع واسطه های التهابی محلول و سایتوکاین به آسانی می توانند عدم چسبندگی اپیدرمی را از طریق فضای لایه لوسیدا القا کنند. این احتمال وجود دارد که زمانی که برخی از سطوح التهاب در EBA وجود دارد ، لایه لوسیدا خیلی بیشتر از منطقه زیرلامینا دنزا جهت تخریب پروتئولیتیک آسیب پذیر می باشد. بنابراین ، صفحه تقسیم تاولی یک روش مناسبی جهت تمایز EBA از دیگر بیماری های تاولی زیر پوستی نمی باشد.
تشخیص ایمونوفلورسانس مستقیم DIF
با این تعریف ، بیماران مبتلا به EBA رسوبات IgG در DEJ از پوستشان دارند.(۱۹۸۱ et al ) این با DIF از نمونه بیوپسی به دست آمده از یک محل در اطراف ضایعات بهتر شناسایی می شود. رسوبات عمدتا IgG بوده اما مکمل IgAوIgM و فاکتور B و پروپریدین ممکن است بخوبی تشخیص داده شود(۱۹۸۱ Yaoita et al 1973Kushniriruk ) رنگ آمیزی DIF یک باند فلورسنت فشرده خطی در DEJ را نشان می دهد Yaoita و همکاران (۱۹۸۱) پیشنهاد کرده اند که رسوبات DIF و IgG مثبت در منطقه زیر لامینا دنزا معیار ضروری برای تشخیص EBA می باشد با این حال در برخی از بیماران LABD مانند ، آنتی بادی رسوبی IgG می باشد (۱۹۹۹Bauer et al ) 1996 Hashimoto et al .
بیماران مبتلا به تاردا پوستی پورفیری (یک سندرم که از نظر بالینی ممکن است تقلید کند از EBA ) اغلب دارای IgG و رسوبات ترکیبی در DEJ شبیه به بیماران EBA می باشد(۱۹۷۳ Epstein et al ) با این حال DIF از بیماران پورفیری نیز مخالفت با بیماران EBA بوده ، همچنین رسوبات ایمنی در اطراف عروق خونی پوست علاوه بر DEJ را نشان می دهد.
ایمونوفلورسانس غیر مستقیم(iif )
بیمار مبتلا به EBA ممکن آنتی بادیهای در خون خود علیه DEJ را داشته باشند(۱۹۸۴Woodley et al ) این آنتی بادی ها می تواند بوسیله iif از سرم بیمار در سوبسترا مری میمون یا خرگوش یا پوست انسان شناسایی شوند. تست مثبت مشخص کننده یک باند فلورسنت خطی در امتداد dej بوده که ممکن است غیر قابل تشخیص از سرم BP باشد. آنتی بادیها در بیماران EBA غشاهای پایه در زیر اپی تلیوم مطبق سنگفرشی متصل شده (پوست ،مری فوقانی ، مخاط دهان و واژن ) و در اکثر ارگان های مزانشیمی مانند رگ های خونی ، کبد ، یا کلیه ،به غشاهای پایه متصل نمی شوند. بنابراین ، هیچ تفاوتی در الگوی اتصال و انتشار بین EBA و آنتی بادیهای BP در این آزمون وجود ندارد(۱۹۸۶ Paller et al) .
تمایز بین EBA ممکن است ویژگی های بالینی ، پاتولوژی و ایمنولوژیکال همراه با CP BP LABD مشترک باشد.
علاوه بر تست های آزمایشگاهی معمول برای اختلالات تاولی (مانندDIF و IIF معمول ) دیگر آزمون های مخصوص برای تایید تشخیص EBA ضروری می باشد. این ممکن است شامل ایمونوفلورسانس پوستی نمک اسپلیت مستقیم و غیر مستقیم (SSSI) میکروسکوپ الکترونی انتقالی میکروسکوپ ایمنوالکترون تست و تسترن بلات و روش ایمونوسوربنت متصل به آنزیم (ELISA) باشد.
میکروسکوپ الکترونی انتقالی
میکروسکوپ الکترونی انتقال استاندارد (EM) از DJE پوستی انسان می تواند تشخیص EBA را نشان دهد. همانطور که در بالا ذکر شد EM یک کاهش در تعداد فیبر های لنگری سرچشمه گرفته رو به پایین به داخل درم پاپیلاری از محفظه لایه دنزا DEJ را نشان می دهد. علاوه بر این ، متخصصین میکروسکوپ الکترون در پوست EBA که آمورف ، الکترون –متراکم ، مواد نامتعارف قرار گرفته تنها زیر لایه دنزا توجه دارند. اگرچه هرگز بطور قطع ثابت نشده این احتمال وجود دارد که این مواد مربوط به رسوبات IgG در منطقه متصل به فیبرهای لنگری میباشد . این امر می تواند نشان دهنده تشخیص EBA باشد.
میکروسکوپ میکروالکترونی (IEM)
طلا استاندارد برای تشخیص IEM ،EBA می باشد. هدف از IEM قرار دادن دقیق رسوبات ایمنی در پوست بیمار (مستقیم IEM ) و یا به قرار دادن دقیق ساختار درون پوست طبیعی که اتو آنتی بادیها در اتصال سرم بیمار (غیر مستقیم IEM) وجود دارد. اگر رسوب در منطقه زیر لامینا دنزا که در آن فیبرهای لنگری به طور معمول وجود دارد ، این شواهد قوی برای EBA می باشد. اگر رسوبات بالاتر تا بیش از همی دسموزوم های کراتینوسیت پایه بالاتر در منطقه لایه لوسیدا باشند، این شواهد قوی برای BP می باشد. IgG پوست در DEJ رسوب نموده که توسط یک آنتی بادی ثانویه ضد IgG انسانی نشان داده می شود. آنتی بادی ثانویه با یک آنزیم مانند پراکسیداز کونژوگه می شود. با انکوبه آماده سازی شده با سوبسترا مانند دی آمینو بنزادین محصول واکنش متراکم الکترون تشکیل می شود. در نتیجه محل رسوبات ایمونوگلوبولین توسط میکروسکوپ الکترونی نشان داده می شود. آنتی بادی ثانویه نیز ممکن است با ذرات الکترون طلای متراکم به جای یک آنزیم کونژوگه شود. در بافت بیماران(EBA رسوبات ایمنی در داخل منطقه زیر لایه دنزا از BMZ نشان داده است (Nieboer et al 1981 Yaoita et al 1980) این محل از رسوبات در BP متمایز شده ، که بالاتر در منطقه همی دسموزوم می باشد(۱۹۷۵Schaumburg et al ) و یا لوسیدا و از cp که در آن آنتی ژن به لایه لوسیدا محدود می شود(۱۹۹۴ Domloge Hultsch et al ) .
این آزمون DIF معمول بر روی پوست اطراف ضایعات در بیمارانی که در DEJ از طریق منطقه لایه لوسیدا بوسیله انکوبه سازی نمونه بیوپسی پوست با ۱ مولار NaCl در ۴ درجه سانتی گراد به مدت حدود ۳ روز شکست انجام می گیرد(Woodleyو همکاران ۱۹۸۳) . آزمون مستقیم sssi استفاده فلودورسین مزدوج IgG ضد انسانی برای متصل شدن به رسوبات IgG در پوست نمک اسپلیت می باشد. اگر اتصال آنتی بادی رسوبات IgG مشخص شود در طبقه پوستی از پوست نمک اسپلیت ، تشخیص EBA ایجاد می شود. در مقابل ، اگر طبقه پوستی بدون اتصال و برچسب فلورسنت در طول سقف اپیدرمی از پوست نمک – اسپلیت مشاهده شود ، EBA به طور موثر رد شده و تشخیص BP پیشنهاد می شود(Gammon et al 1990 )
SSSI غیر مستقیم
این آزمون برای تشخیص آنتی بادیهای ضد BMZ در سرم بیمار طراحی شده است. این IIF معمول در سوبسترا پوست انسان قبلا شکست از طریق لایه های لوسیدا بوسیله انکوبه برش های پوست با ۱ مولار NaCl انجام می شود. این محل های شکسته شده آنتی ژن BP در سمت اپیدرمی از اسپلیت و تمام اجزای BMZ دیگر در سمت پوستی می باشند. هنگامی که پوست طبیعی انسان از طریق DEJ با این روش شکسته شده و به عنوان یک سوبسترا برای IIF جهت آزمون سرم بیماران مبتلا به بیماری های تاولی خود ایمنی اولیه استفاده می شود(مانندBP وeba ) آنتی بادیهای EBA به طبقه درم از سوبسترا پوست نمک اسپلیت متصل شده ، در حالی که آنتی بادیهای BP به سقف اپیدرمی متصل می شوند(۱۹۸۴a Gammon et al ) .
این آزمون ممکن است در سرعت تشخیص بیماران EBA از بیماران فشار خون مفید باشد. این امر بطور خاص مهم می باشد زیرا EBA و BP ممکن است پارامتر های بالینی ،بافتشناسی و ایمنولوژی یکسان داشته باشند.
در حالی که SSSI می تواند در تشخیص اتو آنتی بادیها در سرم بیماران و ایجاد تشخیص BP یا EBA مفید باشد ، آن را باید ذکر نمود که الگوی پوستی رنگ آمیزی بطور خاص برای EBA طولانی تر در نظر گرفته نمی شود . دریک مطالعه ، یک رنگ آمیزی پوستی اپیدرمی ترکیب شده در ۵% از ۹۸ نمونه سرم BP و ۴۵% از ۲۳ نمونه سرم CP دیده می شود(Ghohestani 1997 ) همه از سرم های ۱۰ )EBA بیمار . گرچه تنها رنگ پوستی را نشان دادند . با این وجود ، یک الگوی رنگ آمیزی پوستی منحصر به فرد با استفاده از روش SSSI ممکن است در چندین بیماری های تاولی زیر پوستی دیگر علاوه بر EBA دیده می شود این ممکن است در SLE تاولی (۱۹۹۳Gammon and Briggaman ) یک بیمار bp مانند که در آن بیماران اتوآنتی بادیهای تا ۱۰۵ کیلو دالتون گلیکوپروتیئن لایه لوسیدا دیده می شود که ربطی به لامینین – ۵ ندارد (۱۹۹۳ Chan et al ) یک زیر مجموعه از بیماران CP که اتوآنتی بادیهای علیه لامینی – ۵ دارند ، یک جز غیر کلاژنی از رشته های لنگری در محفظه لایه لوسیدا (۱۹۹۴ Domlog Hultsch et al ) در یک بیماری تاولی زیر پوستی تازه توصیف شده مرتبط با آنتی ژن لایه های لوسیدا پایین تر ۲۰۰ کیلو دالتون طراحی شده ضد ۲۰۰ p پمفیگوئید دیده شود (۲۰۰۰ Mascaro et al ) در مقابل با EBA بیماری های تاولی با اتو آنتی بادیها برای پروتئین ۱۰۵P جدید یا پروتئین ۲۰۰۰P کیلو دالتون برای درمان کورتیکواستروئید موضعی یا سیستمیک به سرعت پاسخ می دهد و التیام ضایعات بدون زخم و یا شکل گیری میلیا رخ می دهد.
در حدود ۵۰ % تا ۸۰% از بیماران EBA هر دو آنتی بادی ضد بافت و ضد BMZ گردشی دارند (۱۹۹۳ Gammon and Briggaman ) آزمون sssi غیر مستقیم به نظر می رسد حساس تر از iif بوده که بر روی پوست سالم انسان انجام می شود که تیتر های آنتی بادی بالاتری را نشان می دهد (۱۹۸۴ Woodley et al 1982 Gammon et al) در آن زمان هیچ آنتی بادیهای گردشی نمی تواند بوسیله iif معمول یا sssi غیر مستقیم نشان داده شود . در این موارد ، میکروسکوپ ایمنوالکترون مستقیم برای ایجاد تشخیص EBA مورد نیاز می باشد(۱۹۹۷ Hoang –Xuan et al ) .
وسترن بلات
آنالیز وسترن بلات می تواند در ایجاد تشخیص EBA مفید باشد. در یک وسترن بلات ، عصاره های پروتئین خام از غشای پایه پوست آمنیون یا کشت سلولی ممکن است استفاده شود و در معرض SDS-PAGE و الکتروفورز به یک غشاء منتقل شوند . روش دیگر ، نوترکیبی کلاژن نوع VII یا کلاژن نوع VII خالص شده با استفاده از روش های بیوشیمیایی می تواند به عنوان سوبسترا در وسترن بلات ها استفاده شود. غشاء با پروتئین بی حرکت توسط EBA و سرم کنترل انکوبه شدند. اتو آنتی بادیهای EBA به گروه ۲۹۰ کیلو دالتون و یا ۱۴۵ کیلو دالتون در وسترن بلات از پروتین غشای پایه پوست انسان اتصال یافته ، در حالی که سرم های از تمام بیماری های تاول اولیه دیگر متصل نخواهد شد (۱۹۸۴ Woofley et al ) این پروتئین ها نماینده تمام طول زنجیره آلفا از کلاژن نوع vii یا دمین NC1 کروی آمینو – ترمینال آن اغلب موارد محل اپی توپ های آنتی ژنیک آنها از EBA و آنتی بادیهای تاولی SLE به ترتیب می باشد(۱۹۹۵ Jones et al 1993 Lapiere et al 1993 Gammon et al 1984 Woodley et al ) تجزیه و تحلیل وسترن بلات با استفاده از کلاژن نوع vii استخراج شده از سلول های پوست و یا از محیط کشت شرطی از سلول های پوست ممکن است به دلیل پس زمینه غیر اختصاصی اتصال پروتیئن های نامربط در هنگام برخورد با سرم تیتر کم مشکل می باشد. روش دیگر ، موفقیت های اخیر ما در تولید عرضه نامحدود از هر دو کلاژن نوع vii نوترکیب تمام طول خالص شده و دمین nc1 در سلول های انسانی پایدار انتقالی اجازه می دهد به ما از پروتئین های نوترکیب خالص به عنوان سوبسترا برای تجزیه و تحلیل وسترن بطور واضح بدون هیچ اتصال غیر اختصاصی پس زمینه استفاده کنیم (۱۹۹۷a Chen et al 2000a).
روش های ایمونوسوربنت متصل کننده آنزیم (ELISA)
به تازگی چن و همکاران (۱۹۹۷b) مقادیر میلی گرمی از NC1 اصلاح شده پس از تبدیل خالص نوترکیب را در انتقال پایدار سلول های ۲۹۳ انسانی تولید کرده اند و این nc1 برای توسعه ELISA جهت تشخیص اتوآنتی بادی در سرم از بیماران EBA و SLE تاولی استفاده می شوند . در مقایسه با روش های دیگر مانند IIF ، IEM و تجزیه و تحیل ایمنوبلات ELISA بر اساس NC1 دارای چندین مزیت به عنوان یک روش غربالگری می باشد: ۱) این روش سریع تر و کارآمد تر از IIF IEM و تجزیه و تحلیل وسترن بلات بوده و ELISA نیاز به فقط ۱۰-۲۰ میکرولیتر از سرم دارد . با ذخیره دسته هایی از صفحات NC1 پوشیده در ۷۰ درجه و استفاده از آنها نیز مورد نیاز می باشد. ELSIA دارای زمان سنجش زیر ۴ سانت می باشد. ۲) آن برای انجام با روش استاندارد آسان می باشد. واکنش کامل را می توان در چاه میکروتیتر انجام داده و خواننده اسپکتروفتومتر تا اندازه گیری های کمی را انجام دهد. ۳) این روش حساس تر از روش های مرسوم IEM یا IIF بوده ، که آن برای تشخیص سرم EBA با تیتر کم بسیار مفید میباشد. ۴) با استفاده از مقدار استاندارد NC1 برای پوشش چاه شخص می تواند به راحتی کمیت اتوآنتی بادیهای ضد NC1 را تعیین کرد.۵)در حالی که از روش های دیگر (IEM،IIF ایمنوبلات ) کیفی هستند، ELISA فراهم کننده تعداد OD برای مقاسیه مستقیم سرم بوده و ۶) ELSA اتو آنتی بادیهایی که مشخص کننده ساختار سوم و چهارم از آنتی از آنتی ژن می باشد تشخیص میدهد (اپیتوپ کنفورماسیونی ) چرا که این روش تحت شرایط محلی انجام می شود. در مقابل تجزیه و تحلیل وسترن ایمنوبلات اتوآنتی بادیهای نیازمند به یک ساختار سوم و یا چهارم از آنتی ژن را تشخیص نمیدهد زیرا این روش نیاز به دناتوراسیون پروتئین ها با SDS دارد. بنابراین ELISA با استفاده از NC1 نوترکیب یک روش حساس خاص بوده و یک ابزار مفید جهت سرعت غربالگری سرم های EBA و BSLE می باشد.
IIF میکروسکوپی با استفاده از کمبود سوبسترا در مولکول های غشاء پایه
IIF که با استفاده از یک پانل از نمونه های پوست که فاقد مولکول خاص BMZ می باشند از افراد مبتلا به EB ارثی گرفته می شود یک ابزار نسبتا ساده و مفید برای شناسایی آنتی ژن هدف در اختلالات ایمنی تاولی می باشد . این آزمون IIF در سوبسترا پوست از شدیدترین نوع Hallopeau زیمنس بیماران DCE مغلوب که در کلاژن نوع VII کمبود دارند انجام می شود. در این آزمون عدم اتصال آنتی بادی از کمبود کلاژن نوع VII پوست در مقایسه با اتصال مثبت بر روی پوست طبیعی یا ۱۸۰ BP و لامینی ۵ کمبود پوست وجود داشته زمانی که سرم EBA مورد استفاده قرار گرفت (۲۰۰۰ jonkman et al 1998 Vodegel et al ) با این حال محدودیت عمده این روش در دسترس بودن نمونه های پوستی مناسب از افراد مبتلا به EB می باشد.
ساکشن اسپلیت ایمونوفلورسانس
این آزمون مشابه با روش رنگ SSSI بوده ، اما به جای ایجاد جدایی بین لایه های BMZ در شرایط آزمایشگاهی با استفاده از نمک ۱مولار در داخل بدن توسط مکش ایجاد می شود. این روش می تواند سریع تر از روش های سوبسترا پوست نمک اسپلیت به دلیل شکستگی DEJ می تواند در ظرف چند ساعت به جای چند روز انجام گیرد(۱۹۹۸Feliciani et al )
فلورسنت روکش نقشه برداری آنتی ژن (FOAM)
این روش به طور گسترده در دسترس نمی باشد . با این حال ممکن است ارزان تر و سریع تر ازمطالعات فراساختاری با استفاده از IEM می باشد. FOAM بین رسوبات IgG بالای لایه دنزا متمایز همچنین در BP از کسانی زیر وجود دارند، هنچنین در EBA متمایز می شود (۱۹۸۸ Kazam et al 1996 De jong et al این روش نشان می دهد آنتی ژن های مختلف از اجزاء BMZ توسط رنگ آمیزی دور ضایعات پوست بیماران مبتلا به بیماری های خود ایمنی پوست با آنتی بادی های مونوکلونال برای شناسایی اجزای BMZ مانندکلاژن نوع VII و رنگ آمیزی رسوبات ایمنی با استفاده از نشانگر های مختلف می باشد. با استفاده از تجزیه و تحلیل کامپیوتر آنتی ژن های رنگ آمیزی شده BMZ و رسوبات ایمنی رنگ آمیزی شده رنگ آمیزی شده بیش از اندازه یکی بر روی دیگر ، با یا بدون استفاده از میکروسکوپ اسکن لیزر کانفوکال در نتیجه رابطه رسوبات ایمنی برای ساختار BMZ معین می باشد.
همانطور که ما گزینه های مختلف پیچیده تشخیصی را بررسی نمودیم ، ما ترغیب می شویم جهت نشان دادن تغییرات جزئی در معیارهای تشخیصی Yaoita و همکاران (۱۹۸۱) که به شرح زیر میباشد.
- اختلال تاولی در طیف بالینی توصیف شده است.
- بافت شناسی یک تاول زیر پوستی را نشان می دهد.
- انباشتگی رسوبات IgG در DIF مثبت از پوست بیمار
- رسوبات IgG قرار داده شده تا لایه های پایین تر دنزا و یا منطقه زیر لامینا دنزا از DEJ که توسط IEM مستقیم بر روی پوست نشان داده می شود.
- جایگزین ها برای ۴ آیتم عبارتند از نمک- اسپلیت غیر مستقیم یا مستقیم یا ایمنوفلوئورسنت اسپلیت خلاپوست ، IIF با استفاده از کمبود سوبسترا در مولکول های غشا وسترن بلات FOAM و ELISA می باشد.
هنگامی که تظاهرات EBA مانند CP می باشد روش SSSI ممکن است برای افتراق از CP واقعی کافی بوده همچنین آن ممکن است رسوب پوستی از آنتی بادی ها در هر دو بیماری را نشان دهد. در این مثال IEM برای تشخیص این دو بیماری مورد نیاز می باشد.
درمان
EBA یک بیماری مزمن می باشد که اغلب به درمان مقاوم است . EBA برای حداقل چند سال در بیشتر بیماران همچنان ادامه داشته وبهبودی غیر قابل پیش بینی می باشد(Gammon 1993 and Briggaman) از انجا که آن یک بیماری علاج ناپذیری بدون روش درمانی سازگار است ، درمان حمایتی مهم تر می باشد. از جمله مراقبت از زخم جزئی و اولیه و درمان آنتی بیوتیک برای عفونت های پوستی موضعی می باشد. عوامل تشدید کننده مانند تروما ، استفاده از صابون های تند ، و از قرار گرفتن در معرض آفتاب باید اجتناب شود (۲۰۰۰ Jappe et al )بیمار باید آموزش داده شود برای تشخیص عفونت های موضعی پوست و در ادامه مراقبت های پزشکی و درمان آنتی بیوتیکی به سرعت در زمانی که این اتفاق می افتد.
کلشی سین
از آنجا که پاسخ ها به درمان سازگار نمی باشند ، پزشک اغلب نیاز به یک رویکرد تجربی برای درمان دارد. این منطقی است برای پزشک امتحان کردن روش های درمانی در جهت استفاده از آن درمان ها با کمترین اثر جانبی لیست شده می باشد . به عنوان مثال ، چندین گزارش از بیمارانی با فنوتیپ های کلاسیک و التهابی از EBA که به دوزاژبالایی از کلشی سین پاسخ می دهد وجود دارد (۱۹۹۴Meghed and Scharfette Kochanek 1996 Cunningham et al کلشی سین یک داروی دسته اول خوب می باشد زیرا عوارض جانبی آن در مقایسه با سایر گزینه های درمانی نسبتا خوش خیم می باشند. یکی از مشکلات باکلشی سین این است که بسیاری از بیماران با EBA بیماری التهابی روده داشته و قابل پیش بینی وابسته به دوز عوارض جانبی گوارشی از کلشی سین ایجاد شده آن را در این بیماران غیر قابل استفاده می نماید . حتی بیماران بدون بیماری التهاب روده تعریف شده بالینی ممکن است قادر به تحمل حتی دوز پایین از کلشی سین بدون رنج درد شکمی و اسهال نمی باشند . اینکه چگونه کلشی سین در EBA عمل می کند نامشخص است، اما شواهد وجود دارد که کلشی سین می تواند تولید آنتی بادی ها توسط سلولهای پلاسما را کاهش داده و همچنین ممکن است سلولهای مشخص آنتی ژن از آنتی ژن مشخص به سلولهای T را مهار نماید . بنابراین ، این دارو ممکن است در دو سطح عمل نماید مهار شروع خود ایمنی و مهار تولید اتوآنتی بادی. تجربه ما این بوده که بیمارانی که در بهترین کلشی سین عمل می کنند آنهایی قادر به دریافت تا ۱.
۵.۵-۲ میلی گرم در روز می باشند. ما به آرامی ۰/۰۶/۴ میلی گرم در روز شروع و پس از آن هر دو هفته تا دو برابر دوز تا عوارض جانبی دستگاه گوارش بیمار را آزمایش شود. پس از آن ما توسط یک قرص با امید به دستیابی به بالاترین دوز قابل تحمل برای بیمار استفاده می کنیم .
عوامل سرکوب کننده سیستم ایمنی
بیماران EBA به خصوص با شکل ضربه تاولی کلاسیک اغلب مقاوم به دوزهای بالا از گلوکوکورتیکوئید ها سیستمیک ، آزاتیوپرین ، متوترکسات و سیکلوفسفامید می باشند(Woodley et al 1998) این عوامل ممکن است تا حدودی در کنترل EBA زمانی که آن را به عنوان یک بیماری التهابی مانند EB به نظر می رسد مفید می باشد. EBA دوران کودکی یک زیر مجموعه نادر که معمولا التهابی شکل مانند بیماری BP می باشد، به نظر می رسد پاسخ مطلوب تری به داپسون و پردنیزون نسبت به بیماران بالغ با EBA داشته باشند (CALLOT Mellot et al 1997)
سیکلوسپورین A
سیکلوسپورین یک عامل سرکوب کننده سیستم ایمنی است که به طور عمده در پیوند عضو استفاده می شود ، نشان داده شده که در تعدادی از بیماری EBA مفید می باشد(Connolly 1988 CROW et al 1987 and sander ) دوزهای بالای سیکلوسپورین (>6 میلیگرم /کیلوگرم ) مورد نیاز می باشند . سیکلوسپورین تعداد عوارض جانبی معنی دار با سمیت کلیوی قابل پیش بینی که مهم ترین آن بوده دارد. سمیت کلیوی وابسته به زمان و دوز می باشد. از آنجا که بیمارانEBA تمایل به سالمندان و خطرات کلیوی با توجه به سن از قبل وجود داشته و به دلیل میزان بالای سیکلوسپورین نیازمند کنترل این بیماری بوده ، استفاده از سیکلوسپورین در EBA اغلب مشکل ساز و محدود کننده می باشد . در بیشتر مواقع سمیت طولانی مدت از دارو استفاده از آن تنها به عنوان یک اقدام در آخرین راه چاره موجه می باشد.
دوز بالای ایمونوگلوبولین ها
گزارش شده استEBA نیز به ایمونو گلوبولین داخل وریدی با دوز بالاو پایین (۱۹۹۷ Kofler et al ) پلاسما ادغام با ایمونوگلوبولینها (۱۹۸۶ Furue et al ) و فوتوشیموتراپی extracorporeal پاسخ می دهد (۱۹۹۹ Camara et al، ۱۹۹۷ Gordon et al 1997 . گامون و بریگمن ۱۹۹۳ موفقیت کم و عدم موفقیت با فنی توئین طلا پاسما ویتامینE و یا داسپون را گزارش کردند . متاسفانه درمان موقت اخیر با مایکوفنولات موفتیل همراه با پیوند کراتینوسیت اتولوگ گزارش شد که ناموفق بوده است(۱۹۹۹schattenkircgner et al )
- Photopheresis
Photopheresis در سندرم Sezary میکوزیس فونگوئید و انواع بیماری های تاولی خود ایمنی استفاده می شود (۱۹۹۰ Rook et al ) یک بیمار EBA در یک وضعیت تهدید کننده زندگی به طور چشمگیری به Photopheresis پاسخ میدهد (۱۹۹۵ Miller et al در سه بیمارEBA دیگر Photophesis برخی از پارامترهای بالینی را بهبود داده و به طور قابل توجهی مکش تاولی شرایط بیماران را طولانی می کند ، یک بهبود در چسبندگی پوست اپیدرم خودشان را نشان داده است (۱۹۹۷ Gordon et al ) هر سه بیمار نیز آنتی بادی ضد کلاژن نوع vii در خون خود را کاهش دادند.
ریتوکسیماب
ریتوکسیماب یک مونوکلونال آنتی بادی کایمریک بوده که به طور خاص هدف قرار می دهد سطح سلول mmune نشانگر CD20 که در درجه اول توسط لنفوسیتهای B بیان می شود.
ریتوکسیماب در اصل در درمان نلفوم سلول B مورد استفاده قرار گرفت اما همچنین بطور موفقیت آمیزی در چندین بیماری های خود ایمنی استفاده شده است . تعداد کمی از گزارش در مورد درمان موفق درمان مقاوم EBA با ریتوکسیماب به عنوان یک عامل کمکی وجود دارد (۲۰۰۷Crichlow 2006 Schmidt et al 2009 Saha et al 2007 Niedermier et al ) بهبود بالینی به طور کلی همراه با کاهش در سرکوب سیستم ایمنی که برای کنترل این بیماری ضروری بوده و همچنین کاهش یافتن تیتر های آنتی بادی ضد کلاژن نوع vii می باشد.
جذب ایمنی
یک روش ناشناخته و بالقوه مولد برای درمان بوده که درحال حاضر امکان پذیر است از قطعات نوترکیب کلاژن نوع vii برای جذب اتو آنتی بادیها از سرم یا پلاسما بیماران استفاده می کند.
مطالعات قبلی اپی توپ های خود واکنشی در دمین nc-1 را شناسایی کرده اند. پیتیدها سنتز شده از این اپی توپ ها جفت شده تمایل به ماتریکس ها داشته و نشان داده شده است. اتو آنتی بادیها برای کلاژن نوع vii از سرم بیماران جذب می کند (۱۹۹۳ Gammon et al ) روش اخیر چن و همکاران (۱۹۹۷a ) برای تولید مقادیر میلی گرمی از دمین nc1 نوترکیب در سلول های ۲۹۳ انسانی ایجاد کننده افینیته پلاسما از بیماران یک روش درمانی امکان پذیر می باشد. منطق این روش ، به ویژه در بیماران مبتلا به فنوتیپ التهابی ،توسط رابطه بین سطوح اتوآنتی بادی و توسعه التهاب در DEJ در EBA و SLE تاولی پشتیبانی می کند.
خلاصه
EBA بیماری تاولی زیر اپیدرمی از نظر بالینی ناهمگن به دست آمده می باشد. در اشکال بالینی ، آن یک بیماری ضربه تاولی با شکنندگی پوست و تاول های القاء کننده تروما که دارای کمترین التهاب و التیام با زخم و میلیا – ویژگی هایی که بسیار یاآور اشکال دیستروفیک ارثی از اپیدرمولیز بولوسا می باشند. یک مشخصه EBA اتوآنتی بادیها IgG بوده که برعلیه کلاژن نوع VII در فیبریل های لنگری مورد هدف قرار می گیرند . فیبریل های لنگری ساختارهایی که لنگر اپیدرم و زمینه BMZ آن بر روی درم می باشند . با این حال آن نیز آشکار شده است که EBA ممکن است همراه با تظاهرات بالینی که یادآور پمفیگوئید تاولی BP پمفیگوئید سیکاتریس CP و پمفیگوئید Brunsting پری می باشد مشخص گردد. معیارهای تشخیصی برای EBA عبارتند از (۱) تاول های خود به خودی یا ناشی از تروما شبیه DEB ارثی(۲) شروع در بزرگسالان (۳) سابقه خانوادگی منفی برای EB (4) محرومیت از تمام بیماری تاولی دیگر می باشد.با توجه به ظاهر شدن شکنندگی پوست ناشی از کمبود اتوآنتی بادی القا شده فیبرهای لنگری EBA برای درمان دشوار خواهد بود انواع التهاب مانند BP از EBA به خوبی به کورتیکواستروییدهای سیستمیک و ادجوانت های سرکوب کننده سیستم ایمنی پاسخ می دهد در حالی که انواع گونه های مختلف تاول ضربه ای وmmp مانند به میزان خیلی کمتری این پاسخ ایجاد می شود. استراتژی های نوین درمانی از جمله جذب ایمنی و آنتی بادی مونوکلونال ضد cd20 ریتوکسیماب اثرات سودمندی در مجموعه موارد کوچک دارد.