,فصل ششم
سندروم شوگرن
۶ سندرم شوگرن
مقدمه
سندرم شوگرن یک اختلال خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) است که با خشکی چشم (ملتحمه SICCA و خشکی دهان همراه است که آن هم به علت نفوذ لنفوسیتی از غدد اشکی و بزاقی رخ می دهد.
علائم خشکی در نتیجه ی از کار افتادن غدد و نیز اختلال عملکرد در غده های باقی مانده ناشی از تولید موضعی سایتوکاین ها و متالوپروتئیناز ها می باشد. هنگامی که این شرایط با دیگر بیماری های خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) ارتباطی نداشته باشد، آن را به عنوان سندرم شوگرن اولیه ۱۰SS طبقه بندی می کنند. اما اگر این بیماری همراه با سایر اختلالات خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) از قبیل آرتریت روماتوئید RA لوپوس اریتماتوی سیستمیک SLE درماتومیوزیت ، اسکلرودرما (اسکلروزیس سیستمیک پیشرونده PSS و سیروز صفراوی اولیه دیده شود ، در این شرایط سندرم شوگرن ثانویه نامیده می شود.
متخصصین پوست و متخصصین روماتولوژی باید آگاهی لازم را داشته باشند، با این که بسیاری از خصوصیات بالینی و آزمایشگاهی در بیماران سندرم شوگرن اولیه شبیه به بیماران لوپوس SLE می باشد، به علت شناخت کم از سندرم شوگرن با یک مشخصه بالینی در مراجعه اولیه بیمار نزد پزشکان عمومی ، باید توجه داشت که در یک ANA مثبت بیمار به عنوان لوپوس شناسایی می شود اما بسیاری از بیماران (به خصوص در میان افراد مسن ) دارای بیماری لوپوس بهتر است با معیار های سندرم شوگرن متمایز گردند(در زیر مورد بحث قرار گرفته .)
متخصصین پوست و متخصصین روماتولوژی باید آگاهی لازم را داشته باشند با این که بسیاری از خصوصیات بالینی و آزمایشگاهی در بیماران سنردم شوگرن اولیه شبیه به بیمارن لوپوس sle می باشد به علت شناخت کم از سندرم شوگرن با یک مشخصه بالینی در مراجعه اولیه بیمار نزد پزشکان عمومی باید توجه داشت که در یک ANA مثبت بیمار به عنوان لوپوس شناسایی می شود اما بسیاری از بیماران (به خصوص در میان افراد مسن ) دارای بیماری لوپوس بهتر است با معیار های سندرم شوگرن متمایز گردند(در زیر مورد بحث قرار گرفته است)
در تشخیص بیماری سندرم شوگرن با دیگر بیماری های خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) از قبیل اسکلرودرمی (اسللروزیس سیستمیک پیشروند یا PSS) در ماتومیوزیت و آرتریت روماتوئید اشتراک و همپوشانی وجود دارد. همچنین یک وجه اشتراک قابل توجهی با بیماران فیبرومیالژی که یک اختلال ضعیف شخصیتی همراه با خستگی و سندرم درد متمرکز می باشد وجود دارد.
در این فصل تمرکز بیشتر بر روی تظاهرات پوستی سندرم شوگرن اولیه با تاکید بر روی علائم چشمی تظاهرات دهانی و یافته های پوستی خواهد بود.
روش های درمانی نیز در این فصل مرور خواهد شد و در چهار حوزه اساسی زیر بحث خواهیم کرد:
- روش های بهبود تظاهرات موضعی مربوط به خشکی چشم و دهان
- تشخیص اختلالات مرتبط با خشکی چشم و خشکی دهان مانند عفونت های مخمر دهانی بلفاریت چشم و ریفلاکس معده و نای
- تشخیص و درمان تظاهرات سیتسمیک سندرم شوگرن شامل التهاب ورید های خونی و ویژگی های تکثیر لنفوسیتی
- ارزیابی و درمان خستگی و نشانه های شناختی مبهم که به وضوح نمی توان نتیجه یک فرایند خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) سیستمیک را تشخیص داد اما شبیه به علائم بیماران فیبرومیالژیا می باشد.
پیش زمینه
اولین برخورد با یک بیمار SS در سال ۱۸۹۲ مربوط به یک کشاورز ۴۲ ساله همراه با پاروتید دو جانبه و غده اشکی متورم و بزرگ همراه با نفوذ سلولهای کوچک دایره ای (Mikulicz1982) اتفاق افتاد که توسط یوهان میکولیکس شرح داده شد .از آنجا که اصطلاح سندرم Mikulicz بسیاری از بیماری های مختلف از جمله سل ، عفونت ها، سارکوئیدوز و لنفوم را شامل می شود. این اصطلاح می تواند به دلیل نداشتن اطلاعات پیش آگاهانه و یا درمانی کافی به اشتباه استفاده شود (۱۹۹۲ Daniels and fox) این اصطلاح هنوز هم گاهی اوقات برای توصیف ظاهر بافت نفوذی لنفوسیتی متمرکز شده در نمونه های غدد بزاقی استفاده می شود.
در سال ۱۹۹۳ چشم پزشکی سوئدی بنام هنریک شوگرن یافته های بالینی و بافت شناسی را در ۱۹ زن که ۱۳ نفر از آنها به آرتریت روماتوئید همراه با خشکی دهان و چشم دچار بودند بیان نمود. شوگرن اصطلاح kcs keratoconjunctivitis را برای این سندرم جهت تمایز آن از خشکی چشم ناشی از کمبود ویتامین A(XEROPHTHALMIA) معرفی نمود.
در سال ۱۹۹۳ چشم پزشکی سوئدی بنام هنریک شوگرن یافته های بالینی و بافت شناسی را در ۱۹ زن که ۱۳ نفر از آنها به آرتریت روماتیودی همراه با خشکی دهان و چشم دچار بودند بیان نمود شوگرن اصطلاح KCS Keratoconjuctivitis) را برای این سندرم جهت تمایز آن از خشکی چشم ناشی از کمبود ویتامین Axerophthalmia معرفی نمود.
در سال ۱۹۵۳ مورگان و کسلمن یک مورد بخصوص از یک بیمار مبتلا به سندرم شوکرن را در یک کنفرانس پاتولوژی بالینی ارائه کردند که مورد توجه دوباره دانشمندان قرار گرفت که در شرایط آن زمان به عنوان بیماری Mikulicz شناخته می شد و متعاقبا این بیماری بعد ها سندرم شوگرن ss نامیده شد. در حالی که اصطلاح Mikulitz هنوز هم گاهی برای اشاره به مناطق اپیلتلیال لنفوی که در بیوپسی غدد (۱۹۵۳ Morgan and castleman ) دیده می شوند ، بکار می رود .
ویژگی های بالینی بیماری ss که در حال حاضر آن را به صورت واضح و متمایز تشخیص می دهیم ، در سال ۱۹۵۶ توسط بلوخ و همکارانش طرح ریزی شد . ۱۹۵۶ Bolcj et al موارد قابل توجهی در مورد موارد طبقه بندی انواع خفیف ss وجود دارد که در زیر آن ها را بحث کرده ایم .
Ss اولیه ، یک اختلال خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) سیستمیک با شیوع حدود ۵ درصدی در جمعیت است که با تعداد بالاتر زنان ۹ به ۱ نسبت به مردان دیده می شود و تقریبا مشابه بیماری sle می باشد (۱۹۹۹Tornwall and Michelson fox 2004 Bowman et al ) این امر ss را به یکی از سه اختلالات خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) شایع در بین مردم تبدیل نموده است . هرچند که به مراتب تحقیقات و توجه به درمان نسبت به این بیماری بسیار کمتر از بیماری های sle یا pss بوده است.
دو پیک سنی در بیماری ss اولیه وجود دارد پیک اول بعد از قاعدگی در طول سنین ۲۰ تا ۳۰سالگی و پیک دوم بعد از یائسگی در محدوده سنی ۵۰ سالگی می باشد. در مطالعه ای که توسط چندین مرکز درمانی صورت گرفت . ۴۰ مورد از ss با شروع بروز علایم قبل از سن ۱۶ سالگی بر اساس تورم غدد پاروتید و ویژگی های آنتی بادی و یک دوره خفیف در طول ۷ سال پیگیری بیماران مشخص گردید (۲۰۰۳ Cimaz et al ) .
معیارهای تشخیص
اختلاف نسبتا کمی در میان روماتولوژیست ها در مورد تشخیص بالینی ss در یک بیمار وجود دارد با :
- مشاهده ی یافته های تست های فیزیکی از ناحیه ملتحمه در چشم.
- خشکی دهان و بزرگ شدن غده بناگوشی
- آنتی بادی های ana و anti-ss-a مثبت
تا همین اواخر ، مجموعه های متعددی از معیارهای تشخیصی برای بیماری ss اولیه که بدست افرادی در آمریکا (۱۹۸۶ Robinson et al fox 1992 Daniels and fox و گروه های اروپایی (eec) انجام شد وجود داشت که به طور قابل توجهی متفاوت از یکدیگر بودند. تشخیص های بیماری ss ارائه شده توسط پزشکان اروپایی تقریبا ده برابر با معیار های EEC و دو معیار متفاوت US بودند . این اختلاف های در تشخیص معیارهای این بیماری به سردگمی و گیج شدن در پژوهش ها و تحقیق های بالینی می انجامد.
معیار های اخیر ، توسط مجموعه اتحادیه اصلاح اروپا آمریکا وابسته به اتحادیه معیارهای اروپایی برای بیماری SS ارائه می شود Table 2003 Vitali معیار از زیر مجموعه این طبقه بندی وجود دارد:
- نشانه های خشکی چشم
- علامت های خشکی چشم با آزمون شرمر یا رزبنگال (به متون پایین مراجعه شود)
- علائم خشکی دهان
- آزمون عملکرد غدد بزاقی (sialogram scintigram گردش غیر طبیعی
- بیوپسی از غده کوچک بزاقی
- آنتی بادیهای ss-a یا ss-b
برای تشخیص درست بیماری ss اولیه ، بیماران باید حداقل از ۴ معیار بالا ، یکی از موارد زیر هم داشته باشند
- بیوپسی غده بزاقی مثبت (امتیاز فوکوس <1 در زیر ببینید)
- آنتی بادی ss-a یا ss-b مثبت
چند نکته در مورد اتو آنتی بادی های مرتبط با ss وجود دارد که ارزش بررسی دارند . برخی از نویسندگان از عبارت ss-a و یا b (بیماری شوگرن مرتبط با آنتی ژن a یا b ) و برخی از عبارات ro وla (که بعد از سرم بیمارانی که در ابتدا برای شناسایی این آنتی ژن ها مورد استفاده قرار گرفت نامگذاری شد (۱۹۸۹ chan et al) استفاده می کنند.
آنتی ژن ss-a معادل با آنتی ژن ro تعیین میشود بررسی های ژن کلون شده برای آنتی ژن ss-a نشان داد که این مولکول شامل دو بخش از یک قطعه ۶۰ کیلو دالتونی و یک قطعه ۵۲ کیلو دالتونی ساخته شده است که ساختار Trna به نام Hyrna شبیه می باشد و در پردازش mrna عمل می کند . همچنین یک مولکول با وزن ۴۸ کیلو دالتون بنام ss-b نیز با کمپلکس ss-a/hyrna ارتباط دارد (۱۹۹۰Ben Chetrit fox and ten ۱۹۸۹CHAN ET AL )
وجود یا عدم وجود آنتی بادی برای SS-A/SS-B بطور قابل توجهی با جایگاه اختصاصی HLA-DR که با هم مرتبط می باشند یافت شده است در نژاد قفقازی این ارتباط با جایگاه HLA-DR3 گسترش یافته که همچنین شامل DQ اختصاصی و آلل های پروتئین C4 کمپلمان خون می باشد(۱۹۸۶ Harley et al ) در جمعیت هایی مانند چین و ژاپن که در آن آلل dr3 نادر است با یک هاپلوتیپ HLA-DR متفاوتی با این اتوآنتی بادیهای ذکر شده در بالا ، ارتباط دارد (۱۹۹۱FEI ET AL ) همانطور که در زیر توضیح داده می شود ، برای این آنتی بادی های (متصل شونده به HYRNA) در کمپلکس های ایمنی ) اخیرا نقشی کاربردی در بیماری زایی شناسایی شده است .
حدود ۶۰ درصد از بیماران دارای بیماری SS اولیه آنتی بادی ضد –SS-A دارند و در حدود نیمی از بیماران دارای آنتی بادی ضد –SSA آنتی بادی ضد SS دارند . این امر که آنتی بادی ضد SS-B در غیاب آنتی بادی ضد SS-A حضور داشته باشد ، بسیار نامتعارف است (۱۹۸۷ Gaither et al ) 1989Rader et al ۱۹۸۸Hamilton et al ۱۹۸۶herley et al )1987sesteak et al .
معیار تشخیص بیماری ss ثانویه هنوز توسط اتحادیه اجماع اروپا امریکا بدرستی مطرح نشده است . با این حال در عمل معمولا نیازممندیم که بیماران برای تشخیص صحیح با معیارهای بیماری ss اولیه و علاوه بر ان با معیار های تعیین شده توسط کالج روماتولوژی آمریکا acr برای اثبات وجود یک بیماری بافت همبندی مانند sle ra درماتومیوزیت و یا میوزیت pss و یا سیروز صفراوی همخوانی داشته باشد. برای سهولت مقایسه معیارهای تشخیصی برای sle و pss در جدول ii و iii ارائه شده است.
سندرم شوگرن اولیه
- علائم چشمی (حداقل یک درصد)
- خشکی چشم به صورت رنج آور مقاوم و روزانه بیشتر از ۳ ماه
- احساس عود کننده وجود شن یا سنگریزه در چشم
- استعمال اشک مصنوعی ۳ بار در روز
- علائم دهان و دندان (حداقل یک درصد)
- احساس خشکی در دهان به صورت روزانه به مدت حداقل سه ماه
- احساس ورم غدد بزاقی عود کننده بزرگسالان
- نیاز به نوشیدن مایعات برای کمک به بلع راحتتر غذا
- نشانه های قابل مشاهده خشکی چشم (حداقل یک درصد)
- تست ارزیابی اشک چشم (تست شیرمر)
- رز بنگال
- بیوپسی غده کسیه اشکی با نمره کانونی بیشتر از ۱
آزمایشات غیر طبیعی(حداقل یک درصد)
- آنتی بادی ضد ss-a و ضد ss-a
- آنتی بادی ضد هسته ای (ANA)
- فاکتور ایمونوگلولولین M روماتوئید(IgM)
تشخیص سندرم شوگران اولیه نیاز به داشتن از ۴ از ۶ معیار تشخیصی داردکه شمال بیوپسی غده بزاقی کوچک مثبت و یا آنتی بادی برای آنتی ژن های SS-A/SS-B است.
استثناهایی وجود دارد که شامل پرتودرمانی قبلی برای لنفوم سر و گردن ، سارکوئیدوس ، عفونت هپاتیت C ، ایدز، بیماری پیوندی علیه میزبان و تجویز دارویی که باعث خشکی چشم می شود است.
تشخیص بیماری سندرم شوگرن ثانویه نیازمند وجود بیماری بافت پیوندی و علائمی از خشکی بعلاه ۲ تست بصری برای خشکی دهان و چشم در زمان ثبت کلینیکی در مطالعه گروهی است.
اگر آزمایشات بصری (آزمایشاتی که با چشم غیر مسلح دیده شوند) از خشکی دهان و چشم شامل وجود بیوپسی غده کوچک بزاقی یا آنتی بادی ضد SS-A/SS-B تایید شود تشخیص سندرم شوگرن می تواند در بیمارانی که نشانه خشکی ندارند هم استفاده شود.
استثنائاتی که برای تشخیص SS اولیه وجود دارد شامل رادیوتراپی برای سر و گردن ، لنفوم ساکوئیدوز پیوند علیه میزبان عفونت با ویروس هپاتیت C ویروس T-lymphortropic انسانی نوع i یا همان HIV است . اندازه گیری جریان اشک و بزاق باید در زمانی انجام شوند که داروهایی که عوارض جانبی آنتی کولینرژیک دارند، مصرف نشوند.
معیارهای تشخیص
- ایجاد راش روی گونه های صورت
- راش های صفحه ای مانند(شبه قرص )
- لکه های قرمز
- حساسیت به نور
- ایجاد راش روی صورت
- عکس العمل به نور خورشید، نتیجه آن افزایش و یا توسعه جوش های پوستی
- زخم دهانی
- زخم روی بینی یا دهان معمولا بدون درد
- آرتریت
- آرتریت غیر فرسایشی با درگیری دو یا تعداد بیشتر مفصل های محیطی
- سروزیت (التهاب غشای سروز)
- پریکاردیت یا پلوریئیت
- نقص کلیوی
- مشاهده پروتئین اضافی در ادرار و سلولهای آنرمال (عناصر غیر نرمال در ادرار ، مشتقات قرمز و سفید سلولی و سلولهای توبولی کلیوی)
- اختلالات عصب شناختی
- صرع
- تشنج یا مشکلات روانی در غیاب یا اختلالات متابولیک که بطور شناخته شده ای باعث چنین تاثیراتی می شود.
- مشکلات خونی
- کم خونی وابسته به سلول های قرمز خونی و کمبود سلول های قرمز خونی و کمبود سلولهای سفید خون (لوکوپنی) یا کمبود سلولهای لنفوسیتی(لنفوپنی) یا کمبود سلولهای ترومبوسیتی (ترومبوسیتوپنی) لوکوپنی و لنفوپنی باید رد دو یا بیشتر موارد تشخیص داده شود. ترومپوسیتوپنی که اگر در زمان مصرف نکردن داروهای القا کننده آن تشخیص داده شود.
- مشکلات ایمونولوژیکی
مثبت شدن تست LE مقدماتی ، مثبت شدن تست ضد DNA و مثبت شدن تست ضدSm یا مثبت شدن کاذب تست سیفلیس vdlr
مثبت شدن وجود آنتی بادی های ضد هسته ای در زمان مصرف نکردن داروهای شناخته شده برای تحریک آن.
اگرچه بیماران ss اولیه در معرض خطر مبتلا به لنفوم هستند اما بیمارانی که سابقه لنفوم دارند برای اطمینان از ایجاد گروه نسبتا هنگن جهت مطالعات درمانی و پیشکیری معمولا از تحقیقات کنار گذاشته می شوند.
معیارهای دانشکده روماتولوژی آمریکا برای دسته بندی بیماری اسکرودرمی که به یک معیار بزرگ و مهم و یا دو معیار کم اهمیت تر نیاز دارد به قرار زیر است:
معیار های مهم تر:
اسکلرودرمی ابتدایی با داشتن ضخامت تنگی و سفتی پوست انگشتان و پوستی که در قسمت پروکسیمال (ابتدایی) مفاصل متاکارپولانژیال است ، مشخص می شود. این تغییرات احتمالا تمام سر و گردن و بدنه (سینه و شکم) را درگیر می کند.
معیار کم اهمیت تر:
اسکلروداکتیلی که شامل یک معیار مهم می باشد که در بالا اشاره شد با این تفاوت که فقط محدود به انگشتان می باشد.
وجود زخم های حفره حفره ای روی انگشت یا از دست دادن نرمی انگشت که در نتیجه ایسکمی تحت فشار بودن نوک انگشتان یا از دست دادن نرمی بافت آن ایجاد می شود.فیبروز ریوی که شامل یک الگوی مشبک دو طرفه تراکم های خطی است که در اکثر بخش های بنیادی ریه بر روی عکس اشعه ایکس ادا شده است . این تراکم ها ممکن است بعنوان تظاهرات بالینی خال های پراکنده یا مشبک کندو مانند بر روی ریه فرض گرفته شوند و قابل استناد به بیماری ریوی اولیه نیست.
مشکلات پوشیده و پنهان تشخیص و متدولوژی
دو حوزه متداول نه چندان واضح در تشخیص بالینی با توجه به اختصاصیت و حساسیت ANA و بیوپسی غدد بزاقی وجود دارد.
ANA اغلب به عنوان یک آزمون غربالگری در بیماران مبتلا به بیماری روماتیسمی استفاده می شود. با این حال ، Tan و همکاران (Tan et al 1997) گزارش دادند که فراوانی آن در افراد عادی با ana مثبت با استفاده از سلوهای Hep2 در تیتر ۱:۴۰ ۳۱/۷ درصد در ۱:۸۰ ۱۳ درصد در ۱:۱۶۰ ۵ درصد و در ۱:۳۰ ۳/۳ درصد بود.
با استفاده از تجزیه و تحلیل های بیزی لایتفوت و همکارانش نتایج مشابهی بدست آمد و محاسبه شد که خطر ابتلای فردی با مقدار تیتر ۱:۳۲۰ ANA در بیماری SLE یا SS در حالت پیشرفته در طول دوره ۱۰ ساله کمتر از ۵ درصد می باشد(۱۹۹۷LIGHTFOOT).
شیوع بالای ANA در جامعه نرمال توسط بیماران یا پزشکان بخش مراقبت های اولیه بطور معمول درک نشده است که تشخیص SLE یا SS بر اساس نتیجه غیر طبیعی آزمون آنتی بادی تعیین می شود یا در غیاب مشخصه های بالینی.
متخصص پوست نیز ممکن است برای کمک در تایید تشخیص SS نمونه بیوپسی از غده بزاقی کوچک را درخواست کنند (۱۹۹۲Daniels) به منظور به دست آوردن بیوپسی ، حیاتی است که نمونه به اندازه کافی برداشت شود و از زخمی شدن عصبی که لب را تحریک می کند ، جلوگیری شود . بیوپسی نباید از منطقه ای از مخاط دهانی که در آن التهاب وجود دارد گرفته شود ، چراکه این موضوع می تواند نتایج مثبت کاذب را به همراه داشته باشد(۱۹۸۵BONE ET AL ) 1986 fox and Howell) 1986fox Robinson et al ) .
بیوپسی به طور معمول از لب پایینی متمایل به خط وسط صورت، گرفت می شود زیراکه این محل دارای تغییرات فیبروتیک غیر اختصاصی کمتری است . بیوپسی غدد بزاقی کوچک بعد از بیهوشی موضعی روی مخاط لب زیرین انجام می گیرد. یک برش عمودی ایجاد شده غدد بزاقی کوچک مورد معرض دید قرار می گیرند پنج غده با قیچی بریده می شود زخم به روش معمول بخیه زده می شود (بخیه ابریشم می تواند مورد استفاده قرار گیرد که می تواند در یک هفته حذف شود و یا معادل آن بخیه های قابل جذب را می توان مورد استفاده قرار داد ) برش های بخیه شده می تواند توسط متخصص پوست و یا متخصص روماتولوژی برداشته شود . با تضعیف مخاط اعصابی که درست در زیر سطح بل وجود دارند توسط این روش مورد اسیب قرار نمی گیرند و بیمار از ناحیه لب که در نتیجه بیوپسی بی حس شده است رنج نمی برد.
نمونه ای از بیوپسی غده بزاقی از یک بیمار ss و فردی نرمال در تصویر نشان داده شده است . ویژگی های کلیدی در بررسی بیوپسی غده بزاقی کوچک شامل تعداد کافی از لوبول های با ارزش و تعیین توده متمرکز (یک توده متمرکز اشاره به مجموعه ای از حداقل ۵۰ لنفوسیت دارد) بر اساس بررسی از حداقل ۴ لوبول می باشد. لوبول هایی که به دلیل مکانیسم غیر ایمنی باز شده اند به نام silalidentis به علت پارگی مجاری از آن آزاد میشود. باید از تعیین میزان توده متمرکز منتفی شوند.(Daniels 2000 daniels 1984)
Sialidentis غیر اختصاصی که از جمله می توان به انتشارهای موضعی اشاره کرد یک یافته شایع و قابل قیاس در بیوپسی های غدد بزاقی کوچک در یک جمعیت کنترل مورد مطالعه در موسسه ملی بهداشت می باشد. در هار حال بسیاری از پاتولوژیست ها برای مطالعه این نمونه ها ، تجربه کافی ندارند. در گزارشی اخیر حدود ۵۰ درصد از نمونه های بیماری ss هنگامی که توسط یک پاتولوژیست با تجربه و باسابقه برای بیماری ss مورد بررسی قرار گرفت ، دوباره طبقه بندی شدند.(۲۰۰۲Vivino Gala and Hermann).
بررسی مختصر بیماری زایی و ارتباط آن با علائم بالینی
با وجود تلاش های گسترده صرف مطالعه در علل ایجاد بیماری ss ، بیماری زایی آن همچنان مبهم می باشد. در شرایط کلی ss را می توان به عنوان یک بیماری چند عاملی و پیچیده که در آن فاکتور های محیطی در شورع التهاب در افراد مستعد با پیش زمینه ژنتیکی نقش دارد ، در نظر گرفت.در مقایسه با بسیاری از اختلالات خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) مختص به یک ارگان دیگر یک راحتی خاطر نسبی از بیوپسی غدد بزاقی کوچک در بیماران ss برای محققان یک فرصت به منظور مطالعه اثر متقابل سیستم ایمنی بدن و سیستم عصبی هورمونی فراهم می کند ، بیماری زایی بدنبال تحریک متقابل و پیوسته از سلول های دفاعی پاسخ اکتسابی (وابسته HLA-DR) و ذاتی (مستقل HLA-DR) سیستم ایمنی حاصل می شود.
پاتوژنز بیماری SS شامل چند مرحله مختلف می باشد که بطور شماتیک در شکل ۲ نشان داده شده است.
a)مراحل ابتدایی بیماری زایی این بیماری احتمالا با ایجاد نقص در سلول های اپیتلیال غده ای یا سلولهای دندریتیک استرومای زیرین آنها شروع میشود(۱۹۹۹Tapinos et al ) . این سلولها به طور طبیعی تحت چرخه سلولی آپوپتوز قرار می گیرند اما موش های آزمایشگاهی موتانت با چرخه آپوپتوز غده ای غیر طبیعی بیماری شبیه ss را بروز می دهند. در مدل های حیوانی دارای بیماری ss (مانند موش nod.scid تغییراتی در چرخه آپتوتیک سلولهای اپیتلیال و رگ های کوچک موضعی ناحیه اندتلیال در غیاب لنفوسیت های فعال رخ میدهد(۱۹۹۶Robinson et al ).
- B) محرک های محیطی ممکن است دارای عفونت های ویروسی غددی و یا دیگر عفونت های مداخله کننده ای باشند که سلولهای دندریتیک یا سلولهای غددی را به سمت فعال کردن HLA-INDEPENDET سیستم ایمنی ذاتی ، تحرکی کند. سیستم ایمنی ذاتی با بهره گیری از گیرنده های TOLL و شبه TOLL الگوهای مولکولی حفاظت شده ای را تشخیص می دهد(الگوهای مولکولی مرتبط با پاتوژن ) که با گروها ی زیادی از میکروارگانیسم ها و محصولات آپوپتوتیک مشترک هستند(۲۰۰۳ Takeda kaisho and Akira)
- C) مهاجرت پیوسته سلولهای دندریتیک و لنفوسیتی به غده در نتیجه پاسخ به مولکول های کموکاین ، با اتصال به مولکولهای اختصاصی اتصالی عروق و سلولهای لنفوسیت T و B خاطره ادامه می یابد(۲۰۰۳ Jonsson Gordon and Konttinen) .
فعال شدن لنفوسیت های Tو B در درون غدد و نیز خارج غدد ، ر نتیجه برخورد آنتی ژن HLA-DR ارائه دهنده سلول ها در حضور مولکول های کمک محرک انجم می پذیرد . این پدیده سیستم ایمنی اکتسابی نامیده می شود که پاسخ ایمنی با لنفوسیت های خاطره واتوآنتی بادیها را دائمی می نماید(۲۰۰۳ Sawalha et al ).
- D) تظاهرات خارج غده ای به علت تکثیر لنفوسیت های درون بافت های دیگر و یا تولید اتو آنتی بادی های بیماری زا رخ می دهد. آنتی بادی های Anti-ss-a و ss-b تشکیل یک کمپلکس به همراهی hyrna را می دهند که در عملکرد های پیرایشی شرکت می کند(۱۹۹۹Scoield) این کمپلکس تشکیل شده از پروتئین /rna در معرض ترکیبات RNA تک رشته ای و دو رشته ای قرار می گیرد و این کمپلکس به محل سلولهای آپوپتوتیک رفت و آمد می کند جایی که باعث شروع سیستم ایمنی ذاتی می گردد(McClain et al )1999Scofielf 2001 Kaufman et al ۲۰۰۳ Arebuckle et al ۲۰۰۳ Heinlen et al ۲۰۰۳Sawalha et al 2005)
e ) سیستم های ایمنی ذاتی و اکتسابی می توانند که همکاری محرکی و متقابلی داشته باشند(۲۰۰۳ santiago-Raber et al) مطالعات انجام گرفته بر روی محصولات سایتوکاینی نمونه های بیوپسی غدد بزاقی با استفاده از تکینیک نقشه ژنی ، نقش مهمی برای اینترفرون های نوع I و ii در تدوام این پاسخ ایمنی را نشان می دهد(Gordon and ، jonsson 2002 ogawa et al ۲۰۰۳ Konttinen ) سلولهای دندریتیک پسلاسماسیتی و اپیتلیال غددی می توانند منبع قوی از حضور ifn نوع I در غدد بزاقی باشند. این سلول های یک سری از گیرنده های toll متصل شونده به اپیتوپ های محافظت شده مرتبط با عفونت (مانند لیپوپلی ساکارید ) یا محصولات سلولهای آپوپتوتیک را بیان می کنند.
- f) تخریب غده ممکن است بوسیله perforin/granzyme-a به همان اندازه مکانیسم های لیگاندی fas/fas رخ دهد(۲۰۰۳ Bolstand et al ) با این حال تنها بخشی از غده در اغلب بیماران تخریب می شو د و این احتمال وجود دارد که تولید موضعی سایتوکاین ها ، اتوآنتی بادی ها و متالوپروتئینازها منجر به ایجاد اختلال در باقی بافت غده شود (۲۰۰۲konttinen et aland kasan –ronkainen1992 konttinen et al ).
- g) احساس خشکی به یک جریان عملکردی که درسطوح مخاطی آغاز می شود دارد(به عنوان مثال اعصاب غیر میلینه غشا قرنیه ویا مخاط دهان) که از طریق اعصاب آوران به مناطق خاصی از مغز میانی می فرسند(۲۰۰۲fox and stern1998stern et al ) از مغز میانی (محل هسته های بزاقی و اشکی ) سپس اعصاب آدرنرژیک و ابران و کولینرژیک را جهت تنظیم ترشح به غدد مربوطه می فرستند. این مورد ممکن است علائم بالای sicca یا همان خشکی در بیماران غیر ss از جمله بیماری آلزایمر و فیبرمیالژیا را توضیح دهد.
به طور خلاصه در حال حاضر امکان ارائه روشی که شامل یافته های ژنتیکی (HLS-DR) محصولات اتوآنتی بادی ، ایمنی بافتی ، نتایج بیان ژن در غده و علائم بالینی از خشکی باشد ، وجود دارد.
توزیع به ارگان ها توسط الگوی خانگی سلولهای دندریتیک و لنفوسیت ها تعیین می شود. تمایل به بروز لنفوم در نتیجه تحریک شدید سلول های B-lymphocytes در ارگان های غیر لنفاوی که در آنها تنظیمات موثری همانند ساختارهای لنفاوی وجود ندارد ، رخ می دهد. علاوه بر این ویژگی های سلولی ss ، بیماران خصوصیات آنتی بادی و واسطه های مکمل را نیز که با بیماران SLE مشترک می باشند نشان می دهند.
علائم چشمی و نشانه های در بیمار SS
یکی از علائم چشمی که در بیماران SS اختصاصی می باشد ورم ملتحمه خشک است که به علت تخریب غدد اشکی و به دنبال آن کاهش ترشحات اشکی ایجاد می شود. بیماران ممکن است از نشانه های خشکی چشم ، سوزش احساس وجود جسم خارجی درد نور گریزی شکایت کنند. در موارد شدید بیماران حتی می توانند رشته هایی از فیلامنت های مخاطی متصل به قرنیه داشته باشند.
هنگام ارزیابی یک بیمار دارای علائمی خشکی چشم مهم است که هر نشانه عینی مربوط به خشکی چشم که با علائم بیماری متناسب است تشخیص داده شود . روش های تشخیصی برای این نوع عارضه در اندازه گیری یکپارچگی سطح قرنیه فیلم اشک و تولید اشک شامل رنگ آمیزی رزبنگال ، فلوئورسین ، رنگ امیزی رنگ سبز lissamine و آزمون شرمر می باشند. با استفاده از روش رنگ آمیزی رزبنگال می توان ساییدگی بافت اپیتلیال شبه نقطه ای بخش قرنیه را تشخیص داد و همینطور این رنگ می تواند به مخاط متصل شده و سلول ها را از کار بیاندازد.
در آزمون شرمر یک فتیله کاغذی به نام واتمن بر روی پلک پایینی چشم قرار گرفته و به صورت تا خورده مهاجرت جریان اشکی بیش از ۵ دقیقه را اندازه گیری می کنند . در برخی از رفرنس های چشم پزشکی به این نکته اشاره می شود که آزمون اخیر ممکن است غیر قابل اعتماد باشد. اما دیدن یک چشم پزشک برای ارزیابی کامل مشکلات چشمی مانند زخم قرنیه یا سوراخ شدگی تضمین کننده است.
بیماری های چشمی که با kcs مطابقت دارند شامل بلفاریت (التهاب و عفونت با درجه پایین از غدد Meibomianدر پلک ) کراتیت هرپتیک (معمولا با زونای چشمی ) التهاب ملتحمه (باکتریایی و ویروسی ) بلفارواسپاسم (چشمک زدن کنترل نشده ناشی از افزایش مدار رفلکس عصبی موضعی)سارکوئیدوز ویووئیت قدامی (معمولا همراه با حساسیت به نور مشخص می شود) می باشد. شیوع علائم و نشانه های خشکی چشم به طور معمول با اظطراب افسردگی و یا بعضی از داروها تشدید می شود(۱۹۹۶ pflugfelder).
علائم و نشانه های مرتبط با دهان در بیمار ss
با تخریب غدد بزاقی اصلی و فرعی در دهان ، خشکی دهان و ایجاد می شود. به دنبال آن ، بلعیدن و یا حتی صحبت کردن فرد بیمار سخت می شود . بعضی از بیماران ممکن است با اختلال در بستن دندان ها مواجه شوند، سطوح مخاطی دهان در هنگام بروز خشکی پیشرفته ممکن است حتی چروکیده شده و بزاق هم غلیظ و چسبنده شود. از آنجاییکه بزاق به علت خواص ضد میکروبی و شستشوی مکانیکی دهان را از ایجاد عفونت ایمن می کند بیماران ss می توانند در معرض خطر پوسیدگی دندان ، بیماری لثه و عفونت های مخاطی مانند کاندیدیاز قرار گیرند.
از آنجا که خشکی دهان ، لزوما دردناک نیست در هنگام بروز و افزایش ناگهانی درد باید به دنبال نشانه هایی برای التهاب گوشه های لب و یا کاندیدیاز دهانی در قسمت های زیرین دندان گشت (۲۰۰۰ Daniels) و غدد بزاقی دهان ممکن است متورم شوند.
سیال بودن بزاق را می توان با روش سیالومتری اندازه گیری کرد به این نحو که جریان بزاق با یک لوله کالیبره به مدت ۱۵ دقیقه اندازه گیری می شود . روش سیالوگرافی غدد بناگوشی می تواند باعث بدشکلی لوله های طبیعی و اسکن غدد بزاقی می تواند کاهش جذب و انتشار ردیاب را نشان دهد . بیوپسی غدد بزاقی نیز که در بالا ذکر شد.
پرسشنامه های سلامتی مخصوص بیماران ss تاثیری بر روی تعاملات اجتماعی میان زنان بعلاوه هزینه ترمیم دندان در بیماران ss را نشان می دهند. (ALLISON LOCKER AND FEIN 1999 ) پزشکان (۲۰۰۲ Soto-Rojas and Kraus) معمولا نمی توانند سهم علائم دهانی را برای کیفیت زندگی بیمار تشخیص دهند.
خشکی دهان نمی تواند به تنهایی مسئول خرابی کامل غدد در اکثر بیوپسی های بیماران ss باشد. حتی با وجود اینکه عناصر غده ای موجود در غدد بزاقی رشته عصبی خود نیز واکنش پس تنظیمی گیرنده های موسکارینی (۲۰۰۲ Beroukas et al ) خود را حفظ می کنند اما به نظر می رسد که غیر کارامد باشند(۱۹۹۲ Konttinenet al) رشته عصبی سالم غده به صورت شماتیک نشان داده شده است . غده دارای گیرنده هایی بیشتر از تعداد سیناپس های عصبی است که در میکروسکوپ الکترونی ملاحظه شده که هدفی برای استفاده درمانی ازمواد ترشحی مانند پیلوکارپین یا سویملین را مهیا می سازد.(۲۰۰۱ fox konttinen and fisher) ترشح مطلوب و بهینه غده زمانی که هر دو گیرنده M1 و m3 تحریک شدند مشاهده شده است.
خشکی مخاط دهان اعصاب غیر میلینه را که به سمت مغز میانی هدایت می شوند تحریک می کند و نیز یک ورودی از بخش های بالایی قشر مغز را دریافت می کند. اگر یک سیگنال ویژه برای ترشح مورد نیاز باشد : اعصاب آدرنرژیک رگ های خونی غده را تحریک در حالی که اعصاب کولینرژیک خود غده را تحریک می کنند (۱۹۸۸stern et al ).
در بیماران مبتلا به ss قسمت ملتهب شده غده منجر به اختلال عملکرد باقیمانده غده به علت آزاد شدن سیتوکین ها ، متالوپروتئینازها و اتو آنتی بادیها می شود پدیده خشکی در بیماران مبتلا به بیماری آلزایمر و بیماران مالتیپ اسکلروزیس نشان می دهد که این عارضه در نتیجه ی اختلال عملکرد بخش سفید سابکورتیکال مغز که به بخش هسته ای بزاقی /اشکی مغز سیگنال می فرستد مربوط می شود(۱۹۹۶Fisher et al ) ایجاد علائم سوزش در هنگام خشکی دهان با افسردگی و اظطراب مرتبط می باشد(۲۰۰۱ Bergdahl and Bergdahl) که احتمالا نشان دهنده دخالت عوامل قشری در عملکرد مداری می باشد که عملکرد غده و یا حساسیت قشر از خشکی را تنظیم می کند.
بروز تورم ناگهانی یک طرفه غده ها نشان دهنده عفونت می باشد در حالی که حضور غدد متورم یا بیماری های غدد لنفاوی احتمال ایجاد لنفوم را بالا می برد، فرایندی که به طور معمول در بیماران ss فراوانی بالایی دارد. در این زمینه هر دو اسکن cat و تصویر برداری MRI با کیفیت بالا مفید هستند (۲۰۰۰ Yousem kraut and chlian ) پیشرفت های اخیر در تصویر برداری mri نشان داده اند که با استفاده از تصویر مواد گادولینیم با نمایش تفریق چربی (به نام mri سیالوگرافی کنتراست ) ممکن است تصاویر بسیار خوبی از ساختار لوله ای و همچنین تغییرات کیستیک یا لنفوم را ایجاد کند(۲۰۰۱ Tonami et al ) گزینه دیگر سونوگرافی غدد بناگوشی است ، به ویژه در مراکزی که در آن رادیولوژیست های با تجربه با این روش فعالیت می کنند.(۲۰۰۰ salaffi et al ).
یک عامل مهم دیگردر اورافارنکس بیماران ss ریفلاکس معده و نای می باشد (۲۰۰۳ Belafsky and Postma) از آنجا که ترشحات بزاقی ph دهان را بالا می برد که به طور معمول رفلکس اسید معده را خنثی می کند بیمار ss ممکن است نه تنها برای ریفلاکس معده و مری مستعد باشد ، بلکه حضور ریفلاکس درون نای می تواند عفونت دستگاه تنفسی فوقانی معمول رفلکس اسید معده را خنثی می کند ، بیمار ss ممکن است نه تنها برای ریفلاکس معده و مری مستعد باشد ، بلکه حضور ریفلاکس درون نای می تواند عفونت دستگاه تنفسی فوقانی را ایجاد کند . کاهش یافتن ترشحات مخاطی نیز می تواند به خشکی حلق و نای منجر شود . استفاده از روش های دقیق برای جلوگیری از ریفلاکس و درمان آن ممکن است به طور چشمگیری مدیریت ما را از عود مجدد تغییر دهد (۲۰۰۳ Belafsky and Postma)
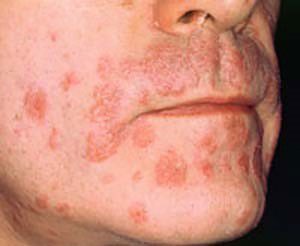
علائم و نشانه های پوستی در بیماران ss
تظاهرات پوستی بیماری سندرم شوگرن شامل :
- خشکی پوست
- اختلالات وازوسپاستیک در محدوده رینود تا آکروسیانوز
- راش های ماکولایی ، پاپلایی و ویزکولی
- عفونت هایی مانند آبله مرغان
- لکه های خون زیر پوست لمس شونده و غیر لمس شونده به علت واسکولیت
- ضایعات آمبولیک و ضایعات ترومبوتیک
- ترومبوز حاد یا مزمن همراه با ادم لنفی
سایر بیماری های پوستی از جمله کهیر یا بثورات پوستی آلرژیک
شکایت ناشی از خشکی پوست در حدود ۵۰ درصد از بیماران رخ می دهد (۱۹۹۹Ito et al )1983 Alexander and provost 1956 et al ) مشخص نیست که خشکی پوست از تراوش غدد چربی یا درون ریز و یا پاسخ ناقص از غدد رسوب شده ایجاد می شود یا خیر (۱۹۹۹Tapinos et al) در نمونه های بیوپسی بسیاری از بیماران ss خشکی پوست مرتبط با ترشح های حاوی لنفوسیت در غدد درون ریز مرتبط بوده است (۱۹۹۸ Sais et al ) مشابه بیماران sle تصحیح آنتی بادی و پروتئین کمپلمان اغلب بطور بالینی برای پوست نرمال شناخته می شود.
با این حال وسعت خشکی پوست و تظاهر بالینی آن که xerosis نامیده می شود اغلب برای انتشار لنفوسیتی شدیدتر از آنچه انتظار می رود می باشد(و تخریب غده ای )
یافته ای شایع در بیوپسی ناحیه عمیق تر پوست عفونت لنفوسیتی پری واکسلار غیر اختصاصی می باشد. مطالعات ایمنی – بافتی نیز یک افزایش پری واسکولاری (اطراف عروقی ) در سلولهای دندریتیک از هر دو انواع مزانشیمی و پلاسماسیتوئید را نشان داده اند . این یافته های بافتی در بیوپسی پوست بیماران ss نیز بسیار رایج است . اما این تراکم اطراف عروق سلولهای لنفوسیتی (و دندریتیک ) ممکن است عامل بسیار مهمی در خشکی پوست بیماری ss باشد.
پیشنهاد شده است که سایتوکاین ها ، فاکتور های عصبی یا فاکتورهای تنگ کننده عروق احتمالا از این لنفوسیت های اطراف عروق و با انتشار سلولهای مونوسیتی ، رها شوند و ممکن است ظرفیت عملکرد طبیعی مویرگ ها یا غدد عرق را مختل کنند . این توضیح از خشکی پوست به خشکی شدید دهان در بیماران ss که بیوپسی لب انها از غدد بزاقی نابالغ همچنان تعداد قابل توجهی از غدد دانه ای شکل و مجرایی در میان تراکم لنفوسیتی متمرکز را نشان می داد شبیه می باشد.
یافته های پوستی بیماران ss شامل پوپورای هیپرگاماگلوبولینمی می شود و غالبا در پاها با حالت متقارن تظاهر می کند. راش های پوستی ممکن است بصورت پوپورای قابل لمس و یا غیر قابل لمس ظاهر شود که این مورد بعد از ایستادن های طولانی مدت و یا سوار شدن در هواپیما به مدت زیاد بیشتر ملموس است(شاید به دلیل کاهش فشار اتمسفر در ارتفاع)
در مقایسه در میان گروه زیادی از بیماران مبتلا به پوپورای هیپر گلوبولینمی که بیماری ss در تشخیص اولیه منتقی شده بود مشخص شد که حدود ۵۰ درصد از آنها به بیماری ss مبتلا می باشند (۱۹۷۱Kyle et al ) ضایعات پوستی غیر قابل لمس بوده و اغلب با فاکتور روماتوئید مرتبط اند(بطور خاص فاکتور روماتوئید مونوکلونال IgM-Kappa) شامل زیر گروه vkiiip زنجیره های سبک می باشند(۱۹۸۶ fox chen et al 1986 fox Carson et al ) این مورد معمولا مرتبط با کریوگلوبولین نوع ii میکس شده می باشد.
بیوپسی پوست رگ های خونی پاره شده وعناصر رسوبی کمپلمان را نشان می دهد . فرض شده است که کمپلکس های ایمنی در انشعابات رگ های خونی بسیار ریز ، به دام افتاده و منجر به فعال سازی پورتئین های کمپلمان به واسطه کمپلکس ایمنی بدن می شود.
در یک گزارش واسکولیت پوستی در ۵۲ نفر از ۵۵۸ نفر (یعنی ۹ درصد) بیماران ss اولیه بروز پیدا کرده (۱۹۸۸ Ramos Casals et al ) و به عنوان پورپورا ضایعات کهیری و پاپول های برآمده مشخص تظاهر می یابد. در گروه های واسکولیتی ۲۷ درصد از آنها واسکولیت کریوگلوبولینمی و ۲۱ درصد واسکولیت کهیر مانند را نشان دادند .
بسیاری از بیماران ، واسکولیت عروق ریز(leukocytoclatic) و تنها ۲ نفر درگیری های عروق با اندازه متوسط را داشتند.
در مقایسه با بیماران بدون تظاهرات واسکولیتی: بیماران مبتلا شیوع بالیی از درگیری های سیستمیک ANA مثبت آنتی بادی های ANTI RO/SS-A و فاکتور روماتوئید نشان دادند.
کریوگلوبولینمی با نتایج اشتباه مرتبط بود.
ویژگی های کرایوگلوبولینمی
- کرایوگلوبولیبرلین ها ایمونوگلوبولینهایی هستند که در سرم در شرایط سرد آزمایشگاهی رسوب می کنند.
- نتایج منفی کاذب آزمایش برای کرایوگلوبولین رایج است
- تست دقیق برای کرایوگلوبولین نیازمند آزمایشگاه با امکانات و آزمایشگر با تجربه است که انجام مجموعه آزمایش را در شرایط مناسب را اندازی کند.
- از بیمار ناشتا (چربی می تواند در آزمایش تداخل ایجاد نماید ) حداقل ۲۰ ml از خون گرفته شود و به یک لوله بدون ضد انعقاد ریخته شود.
- لوله باید در ۳۷ درجه سانتی گراد سانتیریفوژ شود ، سپس به مدت ۷۲ ساعت در دمای ۴ درجه نگه داشته شوند.
کرایوگلوبولینمی به سه زیر مجموعه بالینی نوع iii ii i تقسیم شده است . این طبقه بندی بر اساس دو ویژگی است که یکی بر اساس توانایی تشکیل کولون img و دیگری بر اساس حضور فعالیت فاکتور روماتوئید می باشد. در تظاهرات بالینی نوع آن نوع i کرایوگلوبولینمی معمولا متمایز از انواعii و iii است ولی در مقابل همپوشانی بالینی قابل توجهی بین انواعii و iii وجود دارد.
نوع i کرایوگلوبولینمی با اجزاء مونوکلونال در ارتباط است و غالبا با سرطان خون شدید مرتبط است. علائم چسبندگی شدید در نوع i بیشتر است و احتمال اینکه علائمی مانند نوروپاتی که ممکن است با آمیلودید مرتبط باشد افزایش می یابد.
نوع ii و iii کرایوگلوبولینمی اغلب به نام کرایوگلوبولینمی میکس نامیده می شوند چراکه آنها دارای هر دو ترکیب igg و img بوده اند . ترکیب پایین c4 (یا به عنوان بیمار c4 صفر ) بسیار شایع بوده ، پس کاهش نامتناسب در سطوح c4 معمولا دیده می شود.
در مقابل برای عارضه گلومرولونفریت لوپوسی ، عفونت گلومرولونفریت غشایی- نفوذی به علت ایجاد کرایوگلوبولینمی ، معمولا یک بازنمود دوم محسوب می شود.
واسکولیت مرتبط با کرایوگلوبولینمی میکس شامل رگ های خونی با اندازه کوچک و متوسط می باشد. بیماری عروق با اندازه کوچک از بیماری عروق با اندازه متوسط شایع تر می باشد.واسکولیت مرتبط با کرایوگلوبولینمی ترکیبی ، ممکن است به علت عفونت های ویروس هپاتیت HCV C ایجاد شوند و تشخیص بیماری SS وجود همکاری HCV را هم رد نمی کند.
همچنین برای یادآوری می گوییم که درمان با اینترفرون آلفا (فرم استاندارد و یا Pegylated ممکن است در نوع ii کرایوگلوبولین ترکیبی مربوط به بخشی پوستی و یا در دیگر تظاهرات بیماری همانند اساس عفونت hcv باعث شدت علائم شود.
در واقع تمام بیماران مبتلا به نوع ii کرایوگلوبولینمی ترکیبی برای تست فاکتور روماتوئیدی مثبت هستند. بیماران ss با مونوکلونال rf و نوعii کرایوگلوبولینمی ترکیبی دارای فراوانی بیشتری نسبت به افزایش لنفوم غیر هوجکین می باشند.
اختلال در عصب های محیطی در بیماران مبتلا به واسکولیت کرایوگلوبولینمی که در ۸۰ درصد موارد رخ می دهد ، بسیار شایع است . رایج ترین نوع آن ، پلی نوروپاتی دیستال همراه با تمایل بر اندام های تحتانی است . مونونوریتیس چندگانه (التهاب عصب منفرد) ممکن است با شیوع کمتر نیز رخ دهد.
دانشمندان واسکولیت را در ۳۰ درصد موارد سندرم شوگرن اولیه و ثانویه گزارش کرده اند(۲۰۰۴ Bernacchi) پورپورای قابل لمس نیز در بیماران ss ایجاد و(Alexander1987and provost) با نمونه های بیوپسی واسکولیت لوکوسیتوکلایتیک را نشان می دهد(۱۹۹۸Ramos Casals et al ) و ممکن است با سیستم اعصاب مرکزی (۱۹۹۷Provost Waston and simmons) یا با بخش ریوی درگیر شود(۱۹۹۷Konishi et al )
واسکولیت کهیری در ارتباط با ss نیز گزارش شده است (۱۹۹۵ o Donnell and Black ) این واسکولیت تا حدودی شبیه به خود بیماری کهیر است اما ضایعاتش به طور معمول ممکن است به مدت ۳ تا ۴ روز همراه با درد طول بکشد. این نوع واسکولیت ، همچنین در بیماران مبتلا به sle هم گزارش شده است.
مطالعات هیستوپاتولوژی ضایعات واسکلولیت ss واسکولیت کلاسیک لوکوکلاستیک همراه با تخریب نوتروفیلی کناره دیواره های عروق ریز و نکروز فیبروتوئید نشان داده است . همچنین یک الگوی جدا از تراکم لنفوسیتی دیواره عروق هم به اثبات رسیده است (۱۹۹۲Provost and Watson1997Provost Waston and Simmons o Brien) .
بیماران دارای آنتی بادی ضد سیتوپلاسمی نوتروفیل (ANCA) در بیماران SS اولیه تا حدودی کمیاب اند و در زمان مشاهده نیز معمولا همراه با آنتی بادی P-ANCA (پیش هسته ای )هستند در تفسیر آنتی بادی های نوع ANCA در بیماران SS باید با دقت و احتیاط عمل نمود از آنجایی که ممکن است نتایج مثبت کاذب هنگام حضور دیگر آنتی بادی های ضد هسته ای بدست آید(۱۹۹۶Merkel et al) 1997Merkel et al).
هرچند که در بسیاری از دیگر اختلالات خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن)، آنتی بادی های ضد سلول های اندوتلیال وجود دارند و با واسکولیت پوستی قوبا ارتباطی ندارند اما در برخی زیر مجموعه های بیماران ss یافت شده اند (۱۹۹۷ Navarro et al) آنتی بادی های ضد کاردیولیپین نیز در یکی از زیر مجموهای دیگر بیماران ss دیده شده و به طور کلی از ایزوتایپ آنتی بادی iga محسوب می شوند و همچنین در بیماران sle با شیوع کمتری ، ترومبوز در آنها بورز می کند(۱۹۹۲ Asherson et al ).
باید خاطر نشان کرد که تظاهرات پوستی غیر واسکولیت در بیماری سندرم شوگرن در بیماری های مانند ویتیلیگو(پیسی) آنتودرما آلوپشیا (طاسی موضعی) و لنفوم پوستی هم گزارش شده است(۲۰۰۴Roguedas et al) بروز علائم آنتودرما با لنفومای سلولهای b مرتبط است.(۱۹۹۳ Jubert et al ).
از تظاهرات بالینی پوستی دیگر می توان عارضه آمیلوئیدزیر پوستی را نام برد(۲۰۰۵Yoneyam )(1993Pablos) در تحقیقی ضایعات اریتمای شبه – چندفرمی، اریتمای شبه پرس تانس و اریتمای شبه نودوزیوم (۱۹۹۸Yamamoto Katayama and Nishioka) به همراه سندرم سوییت گزارش شده است(Rpguedas et 2005 Foster et al )(۲۰۰۴ Bernacchi et al )(2004 Ramos Casals et al 2004al)
عارضه رینواد در ۳۰ درصد از بیماران مبتلا به ss اولیه گزارش شده ولی وازوموتور ناپایدار و شدید باید برای تشخیص وجود pss(معمولا با تلاتژیکلازی و کلسینوز مشخص می شود) و یا کرایوگلوبولینمی در نظر گرفته شود (۱۹۹۹Tektonidu et al ) 2004 Manoussakis et al ۲۰۰۴ Ramos-casals et al2005 pirildar et al ).
ضایعات پوستی مربوط به انگشت ها(که غالبا به علت تراکم سلول t در بیوپسی بستر ناخن می باشد) همراه با وازواسپاسم که در زمان قرار گرفتن در معرض سرما تحریک می شود و به نام های chilblains و یا perniosis (هر دو واژه به معنی سرمازدگی ) شناخته می شوند، ارتباط نزدیکی دارد که همچنین با anti-ssa نیز مرتبط است . ضایعات ممکن است در بیماری های ss یا sle تا بیش از ۱۰ سال ادامه داشته باشد(۱۹۸۹Rustin et al ) (1978Millard and Rowell) (1999Franceschini et al ).
به مشکلات بالقوه همانند آترواسکلروز یا آمبولی ، عروق انگشتی در افراد سیگاری (بیماری بورگر) و التهاب مونو نورون چند گانه باید در بیماران مبتلا به کبودی ناشی از سرمازدگی توجه کافی شود . با دیدن تغییرات ایسکمی یا قانقاریای شدید، زخم شدن کلسیفیکاسیون دیستروفی همراه با چرک باید بیماری های اسکلروز سیستمیک عفونت هوایی بافت های عمقی را در نظر داشته باشیم و حتی ممکن است عمل جراحی اورژانسی – پزشکی هم نیاز باشد.
بروز تاولی زیر پوستی درماتوز شبیه به تاول های بیماری SLE همراه با آنتی بادی علیه کلاژن تایپ VII در بیماری مبتلا به SS اولیه که معیار های بیماری SLE در انجمن روماتیسمی آمریکا را درآن زمان شامل نمی شد گزارش شده است (۲۰۰۲ Gyulai et al ) .
در بین بیماران مبتلا به ss در مناطق آسیایی یک یافته پوستی مسری با نام اریتمای حلقوی سندرم شوگرن(AE-SS) در نسبت بالایی از بیماران آن منطقه یافت شده است (Ruzicka 1994 Katayama et al 2001Katayama and kohriyama 1997 Watanabe et al 1996 Watanabe et al 2005Morji et al 1991et al ).
اشخاصی که در دوران طفولیت مورد تهاجم این بیماری قرار گرفته اند (۱۹۹۵Miyagawa) . اگرچه این تاول شبیه به نمونه های scle می باشد اما از نظر بافت شناسی می توان آن ها را با تراکم لنفوسیت های شبه آستین های کت در اطراف زائده های ، مشابه با اربتمای دیسکی شکل متمایز و تشخیص داد. در این خصوص در مطالعه ای زنی قفقازی مبتلا به ss دارای ae-ss گزارش شد ه(۲۰۰۰ Haimowitz et al ) بسیاری از این بیماران آنتی بادی با اپی توپ ۶۰ کیلو دالتونی ss-a دارند.
از آنجا که بسیاری از بیماران مبتلا به ss اغلب برای درمان از داروهای متعددی استفاده می کنند ، تشخیص افتراقی شیوع پوستی همیشه همراه با مجموعه زیادی از داروها می باشد.
همچنین بیماران ، بویژه آنهایی که دارای نقص ایمنی سرکوب شده ناشی از درمان می باشند می توانند مبتلا به عفونت شوند. بیوپسی با ایمونوفلورسانس های غیر مستقیم می تواند در افتراق این دو مورد از واسکولیت یا سایر درماتوزهای مرتبط با ss بسیار مفید باشد.
یافته های سیتسمیک در بیماران مبتلا به سندرم شوگرن (ss)
تظاهرات بیماری خارج از غده ای به دو دسته غیر احتشایی (پوست درد مفاصل درد عضلانی ) و احشایی (ریه قلب کلیه دستگاه گوارش غدد درون ریز سیستم عصبی مرکزی و محیطی )تقسیم می شود. در مورد تظاهرات پوستی قبلا در بالا توضیح داده شده است . اغلب در بین نشانه ها یا علائم بیماری های sle و ss همپوشانی قوی وجود دارد (۲۰۰۴ Maniussakis et al ).
توزیع تقارنی و داشتن درد مفاصل (یا ورم مفاصل ) معمولا شبیه به یکی از دو بیماری RA یا SLE هستند(۱۹۹۳Paese et al )2004 Manoussakis همچنین بیماران ممکن است الگویی با عنوان آرتروز فرسایشی را نشان دهند (۲۰۰fox ) ایجاد مفصل متورم نابرابر باید به عنوان فرآیندی اضافی از قبیل آرتروپاتی عفونی یا کریستالین پیشنهاد گردد.
درد عضلانی و ضعف مکررا رخ می دهد (۲۰۰۲ Lindvall et al ) عارضه پلی میوزیت احتمالا با علائم خشکی شدید مرتبط می باشد. دیگر مراحل شامل درد روماتیسمی ناشی از ماهیچه درگیری میوزیت بدن و میوپاتی ناشی از داروها (از جمله استاتین و استروئید ها) حتما باید در نظر گرفته شود. همچنین مشکلات عصبی از جمله واسکولیت ترومبوز و پارانئوپلاستیک ممکن است همراه با ضعف بروز کنند. افزایش مقادیر واکنش دهنده های فاز حاد ، آنزیم هیا عضلانی استفاده از دستگاه الکترومایوگرام و حتی بیوپسی عضلانی احتمالا مورد نیاز می باشد . دردهای عضلانی مرتبط با فیبرومیالیژ شایع است (۱۹۹۵ Bonafede Downwy and Bennett) .
مشخص شده که پنومونی بینابینی و خشکی شدید نای و نایژه شایع ترین درگیری های ریوی در ss هستند (۱۹۹۶ Quismorio) طبقه بندی پنوموونی بینابینی(Battista et al 2003) با تشخیص چندین زیر مجموعه از جمله پنومونی بینابینی لنفوسیتی (lip) پنومونی بینابینی معمول (uip) برونشیولیت مزمن و پنومونی سازماندهی شده (Boop) و پنومونی غیر اختصاصی در حال تغییر می باشد. همچنین بیماران ss ممکن است دچار بیماری لنفوم معده وابسته به موکوس یا همان MALT و انواع دیگر لنفوم ریه شوند(۱۹۹۲ Constantopoulos Tsianos and Moustsopoulos) علت های دیگر آن شامل حساسیت زیاد ریه و مسمومیت دارویی(از جمله متوترکسات یا عوامل آلکیه ) و همچنین عفونت های رایج در بیمارانی که داروهای سرکوب کننده سیستم ایمنی دریافت می کنند می باشند.(۲۰۰۲kim et al ).
پریکاردیت و افزایش فشار خون در ریه می تواند در بیماران مبتلا به ss رخ دهد(۱۹۹۶Gyongyosi et al ) تست های کاردیوواسکولار مشخص نموده که نوروپاتی اتونومیک مانند پاسخ فشار خون با دست مشت شده مانور والسالوا، پاسخ ضربان قلب به تنفس های عمیق و پاسخ ضربان قلب و فشار خون به ایستادن ممکن است در بیماران ss افزایش یابد عنوان عوامل سببی در این شرایط عنوان شده است (۱۹۹۹Borda et al ۱۹۹۵LI Horsfall and Maini)
تظاهرات بالینی کلیوی شامل التهاب بیانبینی نفریت است که در بیماری ss در تست تحریک آمیزی شایع می باشد(۲۰۰۰ Garmon et al ) برخی از بیماران ممکن است با مواردی مانند فلج وابسته به کاهش غیر طبیعی پتاسیم (۱۹۹۴Siamopoulis Elisaf and Moutsopoulos) سنگ کلیه و یا نرمی استخوان مواجه شوند(FULOP AND Mackay)بدتر شدن وضعیت کلیوی را باید همراه با داروهایی از جمله عوامل ضد التهاب غیر استروئیدی مورد توجه قرار داد. همچنین اخیرا نقش گیاهان دارویی چینی در تشدید شدن بیماری های کلیوی به اثبات رسیده است (۲۰۰۱Nishimagi et al ) بیماران ss ممکن است دارای گلومرولونفریت بوده (که برای آنتی بادی ضد dna دو رشته ای منفی است ) و این نشان دهنده نیاز به مورد توجه قرار دادن آمیلوئیدیس نقص در کمپلکس های ایمنی و یا sle بر آورده نشده همراه با خطا در تست های آزمایشگاهی است (۱۹۹۵ Dabadghao et al) التهاب مثانه در بیماران ss شایع تر است(۲۰۰۳ Leppilahti et al ) و ممکن است حتی شدید شود (۲۰۰۴ shibata et al ) علائم مثانه در بیماران ss ممکن است با مصرف مایعات زیاد بدتر شده و آنتی بادی هایی که به گیرنده های کولینرژیک موسکارینی در سلولهای اپیتلیال مثانه متصل می شوند یافت شوند(۲۰۰۱Beroukas et al )
تظاهرات دستگاه گوارش همراه با اختلال بلع که بخشی به دلیل خشکی دهان بوده و بخش دیگر ممکن است به علت اختلال در مری باشد(۱۹۹۹Feist et al ) در بیماران مبتلا به ss تغییرات آتروفیک خفیف در آنتروم معده نسبت به بیماران کنترل شایع تر بوده اما آتروفی شدید مخاط نادر می باشد(۱۹۹۷ COliin karvonen et al ) بیمار مبتلا به التهاب معده یابد برای باکتری هلیکوباکتر پیلوری مورد آزمایش قرار گیرد به خصوص اینکه این عامل با لنفوم malt در بیماران ss ارتباط دارد (۲۰۰۱ Raderer et al ).
ارتباط علائم خشکی با سیروز اولیه صفرا (pbc) اهمیت دارد (۱۹۹۸Invernizz et al ) اما تفاوت در پروفایل های اتوآنتی بادی نشان می دهد که فرآیند متفاوتی در بسیاری از بیماران وجود دارد(۱۹۹۵Tish ler et al ) .
در بیماران مبتلا به pbc درمان با دارو اسید یورسوداکسی کولیک ممکن است مفید باشد(۱۹۹۸ Zukowski et al ) بیماری سلیاک اسپرونیز همراه با بیماری ss گزارش شده است (۱۹۹۵ SHEIKH AND SHAW STIFFEL)و شناسایی این بیماران که علایم خفیف ویا غیر معمول را نشان می دهند دارای اهمیت میباشد.(Collin Reunala et al )
کم کاری تیروئید به نظر میرسد در بیماران ss شایع باشد(۱۹۹۵perez et al) 2003 D,Arbonneau et al ) در بیماران مبتلا به بیماریهای اتوایمیون تیرویئد نیز ، این بیماری در ۱۰ درصد از بیماران مبتلا به بیماری های خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) تیروئید بروز می کند (۲۰۰۴ Tektonidou et al ) اگرچه پاسخ های ایمنی به آنتی ژن های پانکراس در بیمارن ss دیده می شود اما بروز بیماری های پانکراس بطور قابل توجهی کم می باشد(۱۹۹۳NISHIMORI) بیماران SS غده هیپوفیزی با فعالیت پایین و پاسخ آدرنالی به تست عامل آزاد کننده کورتیکوتروپین دارند (۱۹۹۸JOHnson ey al )
بیماری لنفوپرولیفرات که در آن تعداد لنفوسیتها از حد مجاز افزایش می یابد ، نگرانی جدی برای بیماران مبتلا به ss محسوب می شود زیرا خطری ۴۰ برابری افزایش لنفوم در آنها وجود دارد(۱۹۷۸ Kassan et al ) انواع مختلف بیماری لنفوم در مراکز مطالعاتی اروپایی بررسی شده است (۱۹۹۹Voulgarelist et al ) در سری های اخیر اکثر لنفوم ها در بیماران ss در ناحیه حاشیه ای نیوپلاسم های سلولهای b اتفاق افتاده اند و در بخش های خارج گرهی و گره ها افزایش داشته و معمولا غیر مرتبط با ویروس ها بوده اند (۱۹۹۷Royer et al ) با این حال گزارش های موردی از ارتباط ss با عوامل هفونی مانند عفونت هلیکو باکتر پیلوری (۱۹۸۸Josephs et al ) HHV-6 (2000Nishimura Miyajima and Okada 2000Nakamura et al HTLV-1 و EBV وجود دارد (۱۹۹۳Kamel et al ) حالتی که لنفوم را اورژانسی در نظر می گیریم علائم آن با غدد پاراتید بزرگ شده لنفادنوپاتی موضعی یا عمومی هپاتواسپلنومگالی نشت ریوی التهاب عروقی و هایپر گاماگلوبولینمیا خود را نشان دهند. هیچ یک از این موارد اختصاصی نیستند اما باید مورد توجه قرار گیرند به خصوص اگر با اختلالات سرولوژیکی مانند کاهش هماتوکریت سرعت رسوب بالا و یا خضور کرایوگلوبولین مونوکلونال همراه باشند با انجام بیوپسی از گره لنفاوی مغز استخوان یا غدد بزاقی و یا تصویر برداری مانند ct اسکن ناحیه شکمی می توان بهتر این وضعیت را درک کرد.
تظاهرات نورولوژیکی در حدود ۲۰ درصد از بیماران ss گزارش شده است (۲۰۰۴Delanlande et al ) و ممکن است درگیری سیستم اعصاب مرکزی نوروپاتی جمجمه ای (Urban et al )میلوپاتی و نوروپاتی محیطی در این خصوص دیده شود (۲۰۰۱Barendergt et al) نوروپاتی حسی شیوع بیشتری دارد و همچنین تغییرات التهابی اپینورال در بیوپسی عصبی یافت شده است (۱۹۹۷Grant et al ) دیده شدن حرکت های نامتقارن و نورپاتی حسی ممکن است نشانه ای از التهاب های عروقی کوچک یا اندازه متوسط باشد(ROSLER ET AL ).
یکی از سندرم های بیماری ام اس همراه با التهاب عروقی جلدی با یک فراوانی بسیار بالا در بیماران ss در یک مرکز پزشکی گزارش شده است (۱۹۸۶ Alexander et al) اگرچه تحقیقات در مورد آن هنوز ادامه دارد اما نتایج اولیه مورد تایید قرار نگرفتند (۱۹۹۵ Simminos OBrine et al ) فراوانی بیماری دمیلینه شدن مرکزی شبیه به بیماری sle 1999pender ) با اتصالات اولیگوکلونال غیر طبیعی در حفره مهره های کمری و mri مغزی غیر طبیعی مشابه می باشد. در هر حال مهم است که بیا این مورد اشاره شود که در بیماری ام اس (۲۰۰۱de Seze et al ) و بیماری آلزایمر میزان شکایت از خشکی ناشی از بیماری در بین این بیماران نیز افزایش یافته است که احتمالا از اختلالات جریان برون روی مرکزی در فیبر های عصبی تحت تاثیر استیل کولین نتیجه می شود(۱۹۹۹fisher).
اختلالات روانی از جمله افسردگی و اظطراب در بسیاری از بیماران مبتلا به ss دیده شده و فراوانی بالای آن نشان می دهد که بخشی از فرآیند مهم آن می باشد(نه صرفا در پاسخ به استرس از نوعی اختلال خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) ) (۱۹۹۴ Utset et al ) در هر دو بیماری ss و sle علایم گفته شده بالا غالبا مقدم تر از زمان تشخیص بیماری خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) ظاهر می شوند. (۱۹۹۴ van Dem et al ) غیر طبیعی بودن در آزمایشات عصبی روانی (عمدتا در بخش لوب پیشانی و نیز از دست دادن حافظه ) و همینطور در اسکن pet مغزی در بیماران ss گزارش شده است (۱۹۹۹Belin et al 2000Lass et al ) با اینکه مطالعات ابتدایی نقش پر رنگی را برای آنتی بادی های ضد ریبوزومی p نشان داند مطالعات اخیر برای بیماری ss این داده ها را تایید نکرد (۱۹۹۳ SPezial et al ) نشانه های مهم در آن تغییرات در عملکرد های ادراکی همراه با حافظه ضعیف و تمرکز هستند. هرچند توسط بیماران به صورت کم به آن اشاره می شود اما این تغییرات می توانند در آزمون های اداراکی تایید گردند.
شکایت از خستگی و درد عظلانی که با هم فیبرومیالزی نامیده می شوند شایع می باشد. مرکز دستاوردهای پزشکی مطالعاتی سلامت عمومی (SF-36) و VAS نشان دادند که علایم خستگی و کوفتگی به طور مکرر در هر دو بیماری SS و بیمرای های غیر SS که از خشکی زیاد شکایت می برند وجود دارد(۲۰۰۳ Lwin et al 2001Tensing et al ) در بیماران مبتلا به ss مقدار هموگلوبین ESR و یا CRP علایم خستگی را پیش بینی نمی کنند اختلالات در خوابیدن از علت های مهم خستگی می باشند(۱۹۹۷ Tishler et al ).
لوپوس نوزادان احتمالا در کودکانی که از مادران مبتلا به sle ss و نیز نسبتی از مادرانی که آنتی بادی بر علیه آنتی زن های ss-a و ss-b دارند متولد شده اند یافت می شود اما فاقد علایم ss بالینی هستند (۱۹۹۶Buyone et al ) لوپوس نوزادان با آنتی بادی های anti-SS-A (یا ضد RO) با پروتئین ۵۲ کیلو دالتونی مرتبط میباشد.
تشخیص افتراقی
هنگام برخورد با یک بیمار احتمالا مبتلا به بیماری SS بسیار مهم است که بیماری های دیگری را که با علایم ملتحمه چشم ، خشکی دهان و بزرگ شدن غده پاروتید در ارتباط هستند را هم در نظر گرفت (بررسی در KASSAN و Moutsopoulous) نشانه خشکی چشم می تواند علت های مختلفی از قبیل سارکوئیدوز ، امیلوئیدوز داروها زخم و یا خراش عفونت شرایط التهابی مانند التهاب پلک ها یا پمفیگوئید شرایطی عصبی آسیب پلکی یا اختلال در عملکرد غده اشکی و یا هیپو ویتامینوز ایجاد شود. خشکی دهان نیز می تواند به وسیله داروها (ضد فشار خون ، پاراسمپاتولیتیک ، روان گردان ها) آمیلوئیدوز سارکوئیدوز دیابت شیرین عفونت تروما پرتوافکنی و یا به دلایل روانی ایجاد شود . اختلالات غدد درون ریز بدن هم می تواند غده بناگوشی را همراه با عفونت هایی نظیر اوریون هپاتیت c و یا hiv تحت تاثیر قار دهد عفونت پانکراس دیابت سیروز لنفم و اختلالات رد چربی نیز می توانند منجر به بزرگ شدن آن غدد گردند اختلالا عصبی مانند بیماری ام اس با خشکی نیز مرتبط است.
توانایی تفریق بیماری ss از دیگر اختلالات ایمنی روماتولوژی نیز بسیار مهم می باشد به ویژه هنگامی که اقدامات درمانی می بایست اتخاذ شود . معمولترین سردرگمی و شباهت های زیاد بین دو بیماری در هنگام تشخیص آنها بین شوگرن و sle می باشد . این قضیه حائز اهمیت است که گروه بیمارانی که در حال حاضر به نام lump به عنوان sle می شناسیم .
حداقل ۳ زیر مجموعه که الگوهای متمایزی از HLA0-DR نمودارهای آتوآنتی بادی و ویژگی های بالینی دارند تشخیص دهیم. یکی از زیر مجموعه هیا بیماری SLE عفونت گلومرولونفریت ندارد و دارای ورم مفاصل و بثورات می باشد. این زیر مجموعه معمولا دارای HLA-DR3 آنتی بادی برای SS-A و شباهت بسیار زیادی با سندرم شوگرن دارد. روش های مختلفی برای تشهیص ارتباط بین SS درجه ۱ و SLE وجود دارد . یک روش آسان این است که بدانیم بیماری SS نسبت به بیماری SLE مورد از ۵ معیار مورد نیاز دا دارا می باشد. هر چند که تمایزی دیگری هم وجود دارد و آن اختلافی اندک در زمینه پاتوژنز می باشد.
SLE معمولا با آنتی بادی و مکمل میانجی بافت های آسیب دیده (گلومرولونفریت کمپلکس ایمنی ، افیوزن پلورال و پریکارد ترومبوسیتوپنی و آنمی همولیتیک) مشخص می شود . هرچند که این ویژگی ها در مبتلایان به بیماری SS هم خود را نشان دهند اما از ویژگی هیا مشخصه بیماران SS گرایش انتشار و تولید لنفوسیتی شان می باشد. در پایه ترین سطح اینگونه فرض می شود که غدد بزاقی و اشکی نفوذ لنفاوی کانونی نداشته باشند . حضورشان به عنوان مشخصه SS حضور گیرنده های هدفیاب و معماری سلولهای دندریتیک را بافت های غددی مازاد که از اساس پاتولوژی برای نشانه های خشکی می باشد است . از نقطه نظر بالینی بیماران SS نوع درجه اول به طور جدی باید به تظاهرات نشت یا نفوذ لنفوسیتی به بافت های مختلف در آنها توجه شود . این ناهنجاری می تواند در نتیجه نفریت بینابینی پنومونی بینابینی و همچنین افزایش خطر ابتلا به بیماری لنفوپرولیفراتیو ممانند لنفوم باشند.
همپوشانی بالینی با بیماران PSS نیز با دگرگونی در الگوهای اتوآنتی بادی ها ، ارتباطات سازگاری بافتی و بیوپسی بافتی ممکن است شایان توجه باشد . برخی از بیماران PSS دارای الگویی فیبروتیک در بیوپسی لب خود هستند در حالی که دیگران نفوذ لنفوسیتی دارند(نشان دهنده بیش از یک سندرم همپوسان بنام بیماری بافت همبند ترکیبی)
ارگرچه RA شایعترین اختلال خودایمنی مرتبط با بیماری SS می باشد اما از ویژگی های بالینی RA (خشکی چشم بیشتر از خشکی دهان) تفاوت در الگوی ANA (وقوع نادر آنتی بادی anti-SS-A ) و آنتی ژن سازگاری بافتی مختلف می باشد و نشان می دهد که این اخلالات (به عنوان مثال ،RA بعلاوه SS ) بطور تنگاتنگی به SS درجه ۱ نسبت به SLE همراه با SS درجه ۲ ارتباط کمتری دارد.
در ارزیابی اولیه نیاز به تشخیص اینکه بیمار شواهد کافی حاکی از یک بیماری خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) قابل مشاهده نه تنها یک ANA مثبت دارد یا خیر که این امر دربر گیرنده پروفایل های خاص اتوآنتی بادی مطالعات چشمی ، مطالعات جریان بزاقی و یا بیوپسی لب می باشد . بیمار ممکن است همزمان ، دارای SS ثانویه یا یکی از دیگر از بیماری های خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) (RA اسکلروز سیستمیک و غیره ) و یا به عنوان بخشی از یک سندرم همپوشان با بیماری های خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) دیگر باشد . سایر شرایطی که از SS تاثیر می پذیرند نیاز به ارزیابی دارند. علاوه بر ارزیابی چشم و دهان اقدامات لازم دیگر برای بیماران SS نیز شامل تاریخچه کامل و فیزیکی ESR و CBC پنل جامع سوخت و ساز بدن(از جمله ارزیابی کبد و کلیه ) سرم ایمینوگلوبولین ها ، TSH آزمایش ادرار CXR غدد لنفاوی و یا بیوپسی مغز استخوان مکمل ACE و سرولوژی برای هپاتیت B هپاتیت EBV C HIV به طور چشمگیری مورد نیاز می باشد سرولوژی اتوانتی بادی همانطور که مورد بحث قرار گرف عبارتند از ANA آنتی SS-A آنتی SS-B آنتی SM/RNP آنتی ds-DNA و RF.
درمان
- درمان جلدی
درمان موضعی در بخش پوستی برای بمیاران سندرم شوگرن، برروی عارضه خشکی متمرکز می باشد. اگر بیمارانی از مشکلات بسیار جدی پوست مانند واسکولیت رنج ببرند بیماریشان ممکن است به مدیریت سیستمیک نیاز داشته باشد.درمان کردن ، نیازمند اقدامات همه جانبه بوده و ممکن است نیاز به دوز بالاتر کورتیکواستروئید ها و یا حتی داروی سیکلوفسفامید باشد.
درمان خشکی پوست در سندرم شوگرن با درمان آن در مشکلات پوستی دیگر ، مشابه می باشد. بیمار باید با استفاده از کرمی مرطوب کننده بدون بو موضع را یک یا دو بار در روز مرطوب نماید . مرطوب کننده ها بلافاصله بعد از حمام یا دوش گرفتن در حالی که پوست هنوز مرطوب است ، برای جلوگیری از تبخیر بیشتر به پوست مالیده می شود . در موارد بروز خشکی شدید ، مالیدن پماد به جهت ایجاد سد و خواص محافظتی آن پیشنهاد می شود(مانند ژل وازلین یا آکوآفور) اگر این موارد استفاده میشود مالیدن آن باید روی پوست مرطوب باشد چراکه پماد خودش حاوی آب نمی باشد . روغن اضافی را می توان با یک حوله تمیز ، خشک کرد. گاهی اوقات یک کرم مرطوب کننده دارای بتا یا آلفا هیدروکسی اسید یا اوره می تواند رطوبت بیشتری را ایجاد کند اما در موارد بروز ترک در پوست سوزش و تحریک را دربر خواهد داشت . از حمام یا دوش طولانی مدت با آب گرم ، مخصوصا با مواد پاک کننده بودار باید باید به شدت اجتناب شود.
اگر خشکی پوست با خارش همراه باشد درمان موضعی ملایمی با مواد ضد خارش توصیه می شود. از لوسیون ها و کرم های حاوی منتول ،کافور ، (ضد خارش لوسیون saran) لیدوکائین ۲ درصد (فرمول نروژی تسکین دهنده امدادی Neutrogena، مرطوب کننده ضد خارش ) پاراموکسین (لوسیون ضد خارش غلیظ Aveeno) که به آسانی در دسترس می باشند استفاده شود. آنتی هیستامین های خوراکی باید به دلیل اثرات آنتی کولینرژیک با احتیاط استفاده شوند. گاهی اوقات کوتیکواستروئیدهای موضعی برای درمان خارش استفاده می شوند اما استفاده از آنها باید با پدیدار شدن عوارض طولانی مدت مانند آتروفی پوست و تاکی فیالکسی محدود شوند معمولا ما علاقه ای به استفاده از کوتیکواستروئید های موضعی برای بیش از چند هفته ممتد نداریم نه تنها از آنهایی که فوق العاده قوی هستند بلکه حتی از آنهایی که قدرت متوسط دارند . در موارد ایجاد التهاب پوستی ، درمان موضعی با استروئیدهای قوی می تواند در درمان های سیستمیک مفید باشد.
استفاده دائم از کرم های ضد افتاب بصورت روزانه برای بیماران مبتلا به نقص های خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) توصیه می شود. از آنجا که طول موج اشعه خورشید نه احتمال در طیف UVB تا ۳۲۰ نانومتر ) باعث حساسیت در نقص های خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) می شود بیماران باید از کرم های ضد افتاب با طیف وسیع استفاده کنند کرم های دارای فاکتور SPF تنها محدو به حفاظت از UVB می باشند بنابراین بیماران نمی توانند به سادگی بر روی فاکتور SPF حساب کنند در حال حاضر اغلب کرمهی ضد افتاب موجود دارای حفاظت UVA می باشد که معمولا دارای ترکیبات جاذب شیمیایی UVA مانند پارزول هستند. از آنجایی که طول موج های خارج از محدوده UVB و UVA ممکن است بر بیماری های نقص خود ایمنی ( مثل پسودیازیس . سندرم خستگی مزمن . و میگرن) تاثیر داشته باشد استفاده از ضد آفتاب های فیزیکی بیشتر ترجیح می شود. ضد آفتاب های فیزیکی شامل دی اکسید تیتانیوم یا اکسید روی هستند که منعکس کننده اشعه اند. یکی از ضد افتاب های در دسترس ضد افتاب پوستی حساس به نیتروژن SPF30 می باشدکه از دی اکسید تیتانیوم خالص به عنوان ماده فعال خود استفاده می کند . البته موثر ترین حفاظت کننده ها در برابر اشعه آفتاب لباس های محافظتی می باشند از آنجایی که همانند کرم ها ، احتیاجی به مالیدن ندارند بدیهی است که برای جلوگیری از تماس بیش از حد با نور خورشید عاقالنه آن است که در ساعات تابش نور شدید خورشید بین ساعات ۱۰ صبخ تا ۲ بعد ازظهر در خانه بمانید
- درمان چشمی
علائم خشکی در نتیجه افزایش اصطحکاک همانند حرکت پلک بالایی بر روی سطح چشم ایجاد می شود. این حرکت توسط لایه اشکی که شامل مخلوطی از ترشحات آبی و موسین ها است تسهیل می شود که توسط غده اشکی تولید شده و حاوی انواع پروتیئن ها و مواد مغذی به دست آمده از غدد اشکی و همینطور از سرم (حمل و نقل شده برای اشک توسط غدد اشکی ) می باشد. لایه اشکی توسط یک لایه چربی برای جلوگیری از تبخیر ،تثبیت می شود و این چربیها توسط غده هایی به نام میبومیان واقع در لبه دریچه پایین تر ترشح می شوند. التهاب این غدد منجر به عارضه بلفاریت که یک مشکل شایع در بیماران مبتلا به خشکی چشم است ، می شود.
لیزکننده های مصنوعی : بیماران می توانند از اشک مصنوعی رایج بدون ماده نگهدارنده پمادهای لیز کننده و متیل سلولز استفاده نمایند. دو مورد آخر به علت چسبناک بودنشان در شب استفاده می شود. نگهدارنده های موجود در آن می توانند منجر به تحریک موضعی شوند به ویژه در چشم خشک که در آن غلظت می تواند بالا باشد. دیگر قطره های چشمی مورد تجویز (مانند آنتی بیوتیک ها وقطره های گلوکوم ) هنوز هم ممکن است مواد نگهدارنده تحریک کننده داشته باشند.
اقدامات مختلفی که نیاز است تا لایه اشکی حفظ شود:
- سپر جانبی را می توان در چارچوب عینک نصب کرده باعث کاهش نرخ تبخیر اشک طبیعی یا مصنوعی شود.
- عینک های اسکی یا شنا در کاهش تبخیر بسیار موثر هستند اما ملاحظات اجتماعی استفاده از آنها را محدود می کند.
بطور کلی عینک های آفتابی حاشیه دار تا حدودی در اجتماع قابل قبول تر می باشند.
- اقدامات عمومی دیگر برای به حداقل رساندن از دست دادن اشک شامل استفاده از دستگاه های رطوبت ساز به خصوص در اتاق خواب که زمان زیادی در آن صرف می شود و استفاده گاه به گاه از یک لیف حمام مرطوب روی چشم ها.
انسداد نقطه ای
اگر نصب مکرر اشک مصنوعی ناکافی یا غیر معمولی باشد، انسداد نقطه ای درمان انتخابی خوبی خواهد بود. این روش یک روش بسیار موثر برای حداکثر نگهداشتن اشک در چشم می باشد. این تکنیک شامل آب بندی اشکی که از طریق آن اشک به طور معمول به بینی تخلیه می شود می باشد و ۹۰ درصد از زهکشی از طریق نقطه زیرین رخ می دهد. انواع مختلفی از درپوش های نقطه ای در دسترس هستند و درپوش هایی (به نام درپوش های داخلی کانیکولار) که بر روی سطح قرنیه برآمده به نظر می رسد ترجیح داده می شوند(۲۰۰۵ Hamano) با این حال باید توجه داشت که عفونت های موضعی و حتی واکنش های شبیه عفونت چرکی پوست در اطراف سرپوش گزارش شده اند(Musadiq Mukherji and sandramouli2005kim osmanovic and Edward2005)
برخی از متخصصان چشم هم اکنون از درپوش های موقت برای اطمینان از اینکه انسداد نقطه ای در نتیجه تجمع اشک اضافی نمی باشد ، استفاده نموده اند، با این حال ، درپوش های موقت اغلب به اندازه کافی نقطه مورد نظر را مسدود نمیکند . بنابراین ناموفق بودن در بهبود راحتی از این دستگاه ها به طور موقت استفاده از انسداد نقطه ای دائمی توصیه نمی شود . همچنین درپوش های موقت ممکن است برای جلوگلیری از تغییر دائمی در بیمارانی که عملکرد اشکی تقریبا طبیعی دارند با درمان منا
ب بازیابند مورد استفاده قرار می گیرد در دسترس بودن درپوش های داخلی کانیکولار (که از سطح چشم بیرون نمی آید) و اینکه می توان آنها را بدون جراحی خارج کرد یکی از مزیت های دیگر آن است . زمان انجام لیزر یا کوتر حرارتی دستی را می توان برای بسته شدن دائمی آن استفاده نمود. باید دانست که انسداد نقطه ای یک استراتژی مهم برای حفظ اشک می باشد. در نتیجه دارای مزیت اندکی می باشد مگر اینکه با لیز کننده های مصنوعی در آن هایی که تقریبا هیچ تولید اشکی ندارند تکمیل شود.